
【題目】A、B、C、D是按原子序數(shù)由小到大排列的第二、三周期元素的單質(zhì)。B、E均為組成空氣的成分。化合物F的焰色反應呈黃色。在G中,非金屬元素與金屬元素的原子個數(shù)比為1∶2。在一定條件下,各物質(zhì)之間的相互轉化關系如下圖(圖中部分產(chǎn)物未列出):

請?zhí)顚懴铝锌瞻祝?/span>
(1)A和C分別是_______________。
(2)H與鹽酸反應生成E的化學方程式是_____________________________________________。
(3)E與F反應的化學方程式是_____________________________________________________。
(4)F與水反應的離子方程式是____________________________________________________。
(5)物質(zhì)E的結構式為:_____________;物質(zhì)A-H中屬于離子化合物是:_____________。
【答案】 碳、鈉 Na2CO3 + 2HCl=2NaCl + H2O + CO2↑ 2Na2O2 + 2CO2=2Na2CO3 + O2 2Na2O2 + 2H2O=4Na+ +4OH- + O2↑ O=C=O Na2O2 、Na2S 、Na2CO3
【解析】A、B、C、D是按原子序數(shù)由小到大排列的第二、三周期元素的單質(zhì),B、E均為組成空氣的成分,單質(zhì)B與C反應得到F,F的焰色反應呈黃色,說明F是鈉的化合物,故C為Na,考慮B為O2,E是CO2,則F為Na2O2,H是Na2CO3,A為碳,G是單質(zhì)C、D化合而成,原子個數(shù)比為D:C=1:2,則G中D元素為-2價,且原子序數(shù)D>C,故D為硫,G為Na2S。則
(1)由以上分析可知,A為碳,C為金屬鈉;(2)H是Na2CO3,與鹽酸反應生成二氧化碳和水,反應的方程式為Na2CO3+2HCl=2NaCl+H2O+CO2↑;(3)E與F反應為CO2和Na2O2的反應,生成碳酸鈉和氧氣,反應的化學方程式為2CO2+2Na2O2=2Na2CO3+O2;(4)過氧化鈉與水反應生成氫氧化和氧氣,方程式為2Na2O2+2H2O=4Na++4OH- +O2↑;(5)二氧化碳的結構簡式為O=C=O,含有離子鍵的化合物是離子化合物,則屬于離子化合物的是Na2O2 、Na2S 、Na2CO3。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】實驗室配制500mL濃度為2mol/L的NaOH溶液.選用容量瓶的規(guī)格和所需NaOH的質(zhì)量分別為( )
A.100 mL 容量瓶、40 g
B.500 mL 容量瓶、40 g
C.100 mL 容量瓶、80 g
D.500 mL 容量瓶、80 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在生活和生產(chǎn)中應用廣泛。
(1)根據(jù)最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3和TiO2)表面與水發(fā)生反應:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) ![]() H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1) ![]() H=-44.0 kJ·mol-1,則4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,則4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) ![]() H =_____kJ·mol-1。在恒溫恒容密閉容器中,當該反應處于平衡狀態(tài)時,欲使平衡向正反應方向移動且反應速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒溫恒容密閉容器中,當該反應處于平衡狀態(tài)時,欲使平衡向正反應方向移動且反應速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化劑 D.降低反應的溫度
(2)①用氨氣制取尿素[CO(NH2)]的反應為:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H<0,某溫度下,向容器為1L的密閉容器中通入4 mol NH3和2molCO2,該反應進行到40s時,達到平衡,此時CO2的轉化率為50%。下圖中的曲線表示在前25s內(nèi)NH3的濃度隨時間的變化。如果保持其他條件不變的情況下使用催化劑,請在下圖中用實線畫出c(NH3)隨時間的變化曲線。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某溫度下,向容器為1L的密閉容器中通入4 mol NH3和2molCO2,該反應進行到40s時,達到平衡,此時CO2的轉化率為50%。下圖中的曲線表示在前25s內(nèi)NH3的濃度隨時間的變化。如果保持其他條件不變的情況下使用催化劑,請在下圖中用實線畫出c(NH3)隨時間的變化曲線。_______________。
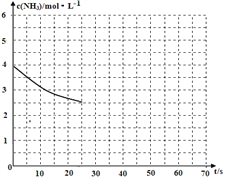
② 若保持溫度和容器體積不變,向平衡體系中再通入2molNH3和2molH2O,此時v正______v逆(填“>”、“=”或“<”)
(3)疊氮酸鈉(NaN3)常用于汽車安全氣囊中,工業(yè) 生產(chǎn)NaN3主要是在175℃時把NaNO3粉末加到熔化的NaNH2中,此外還生成兩種常見的堿性物質(zhì),請寫出上述過程的化學方程式_______________________。
(4)羥胺NH2OH可以看作是NH3分子內(nèi)的一個氫原子被羥基取代的衍生物。以硝酸、硫酸水溶液作電解質(zhì)進行電解,在汞電極上NO3-可轉化為NH2OH,以鉑為另一極,則該電解反應的總化學方程式_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于H2在O2中燃燒反應的描述,正確的是( )
A.該反應屬于放熱反應
B.斷開H﹣H鍵放出能量
C.形成O﹣H鍵吸收能量
D.反應后生成物總能量升高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可再生能源和清潔能源將成為新能源的主力軍,下列關于能源的敘述正確的是
A.化石燃料是可再生能源B.氫能、太陽能是清潔能源
C.化石燃料都是清潔能源D.海洋能、地熱能是不可再生的清潔能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、Q、R皆為前20號元素,其原子半徑與主要化合價的關系如圖所示。下列說法錯誤是

A. Q位于第三周期IA族
B. X、Y、Z三種元素組成的化合物可能是鹽或堿
C. 簡單離子半徑:M->Q+>R2+
D. Z與M的最高價氧化物對應水化物均為強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】交通運輸部在南海華陽礁舉行華陽燈塔和赤瓜燈塔竣工發(fā)光儀式,宣布兩座大型多功能燈塔正式發(fā)光并投入使用。鎂海水電池可為燈塔提供能源,其裝置如圖所示。下列有關鎂海水電池的說法正確的是
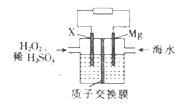
A. Mg電極上發(fā)生還原反應
B. 該電池工作一段時間后,左側溶液質(zhì)量減輕
C. 正極的電極反應式為H2O2+2e-+2H+=2H2O
D. 若電池工作時轉移2 mol電子,則有2 mol H+由質(zhì)子交換膜左側向右側遷移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組為了檢驗濃硫酸與木炭在加熱條件下反應產(chǎn)生的SO2和CO2氣體,設計了如圖所示實驗裝置,a、b、c為止水夾,B是用于儲氣的氣囊,D中放有用I2和淀粉的藍色溶液浸濕的脫脂棉. 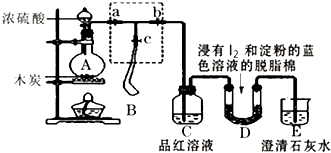
(1)裝置A中盛放濃硫酸的儀器名稱 .
(2)裝置A中發(fā)生反應的化學方程式為 .
(3)實驗時,裝置C中的現(xiàn)象為 .
(4)此實驗成敗的關鍵在于控制反應產(chǎn)生氣體的速率不能過快,因此設計了虛框部分的裝置,則正確的操作順序是(用操作編號填寫). ①向A裝置中加入濃硫酸,加熱,使A中產(chǎn)生的氣體進入氣囊B,當氣囊中充入一定量氣體時,停止加熱;
②待裝置A冷卻,且氣囊B的體積不再變化后,關閉止水夾a,打開止水夾b,慢慢擠壓氣囊,使氣囊B中氣體慢慢進入裝置C中,待達到實驗目的后,關閉止水夾b;
③打開止水夾a和c,關閉止水夾b;
(5)當D中產(chǎn)生現(xiàn)象時,可以說明使E中澄清石灰水變渾濁的是CO2 , 而不是SO2;寫出D中發(fā)生反應的化學方程式 , 當D中反應發(fā)生0.3mol電子轉移時,發(fā)生反應的氣體的體積(標準狀況)是L.
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com