
【題目】下列各選項中兩種粒子所含電子數不相等的是
A. 羥甲基(-CH2OH)和甲氧基(CH3O-) B. 亞硝酸(HNO2)和亞硝酸根(NO![]() )
)
C. 硝基(-NO2)和二氧化氮(NO2) D. 羥基(-OH)和氫氧根(OH-)
科目:高中化學 來源: 題型:
【題目】“墻角數枝梅,凌寒獨自開。遙知不是雪,為有暗香來。”詩人在遠處能聞到梅花香味,表明
A. 分子很小 B. 分子可再分
C. 分子之間有間隙 D. 分子在不停地運動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷元素廣泛存在于自然界,砷與其化合物被運用在農藥、除草劑、殺蟲劑等。
(1)砷的常見氧化物有As2O3和As2O5,其中As2O5熱穩定性差。根據圖1寫出As2O3轉化為As2O5的熱化學方程式__________________________________。

(2)砷酸鈉具有氧化性,298K時,在100mL燒杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,發生下列反應:AsO43-(無色)+12(淺黃色)+H2O △H。測得溶液中c(I2)與時間(t)的關系如圖2所示(溶液體積變化忽略不計)。
①升高溫度,溶液中AsO43-的平衡轉化率減小,則該反應的△H________0(填“大于”“小于”或“等于”)。
②0~10min內,I的反應速率v(Iˉ)= ____________。
③下列情況表明上述可逆反應達到平衡狀態的是_______(填字母代號)。
a.c(AsO33-)+c(AsO42-)不再變化 b.溶液顏色保持不再變化
C.c(AsO33-)與c(AsO42-)的比值保持不再變化 d.I的生成速率等于I2的生成速率
④在該條件下,上述反應平衡常數的表達式K=______________。
(3)利用(2)中反應可測定含As2O3和As2O5的試樣中的各組分含量(所含雜質對測定無影響),過程如下:
①將試樣02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉試液做指示劑,當________________,則滴定達到終點。重復滴定3次,平均消耗I2溶液40.00mL。則試樣中As2O5的質量分數是_________(保留四位有效數字)。若滴定終點時,仰視讀數,則所測結果_________ (填“偏低”,“偏高”,“無影響”)。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). 由圖1可知,As2O3(s)和O2(g)反應轉化為As2O5(s)的△H=-(914.6-619.2)kJ/mol=-295.4kJ/mol,則熱化學方程式為:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol,故答案為:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol;
(2). ①. 升高溫變,溶液中AsO43-的平衡轉化率減小,說明升高溫度,平衡逆向移動,該反應為放熱反應,則△H<0,故答案為:小于;
②. 在0~10min 內,I2的濃度從0變為0.015mol/L,由反應方程式可知,I-減少了0.03mol/L,則0~10min內,用I-表示的反應速率v(I-)=0.03mol/L÷10min=0.003mol/(L·min),故答案為:0.003mol/(L·min);
③. a. 根據物料守恒關系可知,溶液中的c(AsO33-)+c(AsO43-)始終不變,所以c(AsO33-)+c(AsO43-)不再變化,不能說明反應達到平衡狀態,故a錯誤;b. 溶液顏色不再變化,說明各物質的濃度不再改變,反應達到平衡狀態,故b正確;c. c(AsO33-)與c(AsO43-)的比值不再變化,說明正逆反應速率相等,反應達到平衡狀態,故c正確;d. I-的生成速率等于I2的生成速率,正逆反應速率不相等,說明反應沒有達到平衡狀態,故d錯誤;答案選:bc;
④. 由反應方程式可知,在該條件下,反應平衡常數的表達式K=![]() ,故答案為:
,故答案為:![]() ;
;
(3). ①. 用0.02500mol/L的I2溶液滴定含AsO33-和AsO43-的混合溶液,當滴入最后一滴標準液時,溶液由無色變藍色,且30s內不恢復,即為滴定終點,上述混合液用0.02500mol/L的I2溶液滴定,重復滴定3次,平均消耗I2溶液40.0mL,根據As2O5+6OH=2AsO43+3H2O、AsO33-+I2+H2O ![]() AsO43-+2I-+2H+可知:
AsO43-+2I-+2H+可知:
1 1
n 0.02500mol/L×0.04L,n(AsO33-)= 0.001mol,則試樣中As2O5的質量分數是![]() ×100%=50.50%,若滴定終點時仰視讀數,會使讀取的標準液體積偏大,n(AsO33-)偏大,則As2O5的質量分數偏小,所測結果偏低,故答案為:滴入最后一滴標準液,溶液由無色變藍色,且30s內不恢復;50.50%;偏低。
×100%=50.50%,若滴定終點時仰視讀數,會使讀取的標準液體積偏大,n(AsO33-)偏大,則As2O5的質量分數偏小,所測結果偏低,故答案為:滴入最后一滴標準液,溶液由無色變藍色,且30s內不恢復;50.50%;偏低。
【題型】綜合題
【結束】
11
【題目】元素周期表中第四周期元素有許多重要用途。
I.研究發現,釩元素的某種配合物可增強胰島素降糖作用,它是電中性分子,結構如圖1。
(1) 基態V元素的價層電子軌道表示式為___________,分子中非金屬元素電負性由大到小的順序為______________。
(2) 分子中采取sp2雜化的原子有_________,1mol 分子中含有配位鍵的數目是______。
(3) 該物質的晶體中除配位鍵外,所含微粒間作用力的類型還有______ (填序號)。
a. 金屬鍵 b.極性鍵 c.非極性鍵 d.范德華力 e. 氫鍵
II.Fe 與C、Mn等元素可形成多種不同性能的合金。
(4) 圖2-甲是Fe的一種晶胞,晶胞中Fe 的堆積方式為________,己知該晶體的密度為ρg·cm-3,用NA表示阿伏加德羅常數的值,則該晶胞的邊長為__________cm。
(5) 圖2-乙是Fe-C-Mn 合金(晶體有缺陷)的一種晶胞,則與C原子等距緊鄰Fe 的個數為___,該合金的化學式為__________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1-丁醇和乙酸在濃硫酸作用下,通過酯化反應制得乙酸丁酯,反應溫度為115~125℃,反應裝置如圖。下列對該實驗的描述錯誤的是
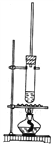
A. 不能用水浴加熱
B. 長玻璃管起冷凝回流作用
C. 為提純乙酸丁酯,可用水和碳酸鈉溶液洗滌
D. 通常加入過量1-丁醇以提高乙酸的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法中正確的是
A. 28g乙烯所含的共用電子對數目為2NA
B. 133.5AlCl3晶體含有的粒子數目為4NA
C. 0.1molCl2與足量石灰乳反應,轉移電子的數目為0.2NA
D. 4.6gNO2和N2O4組成的混合氣體含有的氧原子數為0.2NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com