
【題目】合成氨是人類科學技術上的一項重大突破,其反應原理為N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一種工業合成氨的簡式流程圖如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一種工業合成氨的簡式流程圖如下:
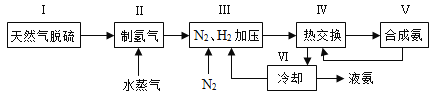
(1)天然氣中的H2S雜質常用氨水吸收,產物為NH4HS。一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式:____________________。
(2)步驟Ⅱ中制氫氣的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
對于反應①,一定可以提高平衡體系中H2的百分含量,又能加快反應速率的措施是 __。
利用反應②,將CO進一步轉化,可提高H2的產量。若1 mol CO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18 mol CO、CO2和H2的混合氣體,則CO的轉化率為____________。
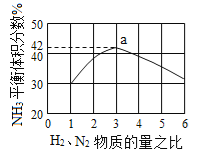
(3)圖(a)表示500 ℃、60.0 MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數:____________。
(4)上述流程圖中,使合成氨放出的能量得到充分利用的主要步驟是(填序號)_____________。簡述本流程中提高合成氨原料總轉化率的方法:_____________________。
【答案】
(1)2NH4HS+O2![]() 2NH3·H2O+2S↓(2分)
2NH3·H2O+2S↓(2分)
(2)升高溫度(2分)90%(3分)
(3)14.5%(2分)
(4)Ⅳ(1分)對原料氣加壓;分離液氨后,未反應的N2、H2循環使用(2分)
【解析】
試題分析:(1)H2S雜質常用氨水吸收,產物為NH4HS,一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,反應過程中生成一水合氨,依據原子守恒和電子守恒配平書寫化學方程式為:2NH4HS+O2![]() 2NH3·H2O+2S↓;
2NH3·H2O+2S↓;
(2)反應①CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+206.4 kJ·mol-1,是氣體體積增大的吸熱反應,一定可以提高平衡體系中H2百分含量,說明平衡正向進行,又能加快反應速率,說明影響反應速率的條件可以是升溫、加壓、增大濃度等,分析反應特征可知反應正向進行且反應速率增大的只有升溫平衡向吸熱反應進行,平衡正向進行反應速率增大;反應是吸熱反應,升高溫度,反應速率增大,平衡正向進行,平衡體系中H2百分含量增大;利用反應②,將CO進一步轉化,可提高H2產量,若1mol CO和H2的混合氣體(CO的體積分數為20%)中 CO為0.2mol,H2的物質的量為0.8mol,與H2O反應,得到1.18mol CO、CO2和H2的混合氣體,依據反應前后氣體體積不變,增加的部分應該是起始的水蒸氣的物質的量為0.18mol,設轉化的一氧化碳的物質的量為x,依據化學平衡三段式列式計算
CO2(g)+3H2(g)△H=+206.4 kJ·mol-1,是氣體體積增大的吸熱反應,一定可以提高平衡體系中H2百分含量,說明平衡正向進行,又能加快反應速率,說明影響反應速率的條件可以是升溫、加壓、增大濃度等,分析反應特征可知反應正向進行且反應速率增大的只有升溫平衡向吸熱反應進行,平衡正向進行反應速率增大;反應是吸熱反應,升高溫度,反應速率增大,平衡正向進行,平衡體系中H2百分含量增大;利用反應②,將CO進一步轉化,可提高H2產量,若1mol CO和H2的混合氣體(CO的體積分數為20%)中 CO為0.2mol,H2的物質的量為0.8mol,與H2O反應,得到1.18mol CO、CO2和H2的混合氣體,依據反應前后氣體體積不變,增加的部分應該是起始的水蒸氣的物質的量為0.18mol,設轉化的一氧化碳的物質的量為x,依據化學平衡三段式列式計算
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2 kJ·mol-1
CO2(g)+H2(g)△H=-41.2 kJ·mol-1
起始量(mol) 0.2 0.18+x 0 0.8
變化量(mol) x x x x
平衡量(mol)0.2-x 0.18 x x+0.8
則0.2-x+x+x+0.8=1.18,則x=0.18。則CO轉化率為![]() ×100%=90%;
×100%=90%;
(3)依據反應特征N2+3H2=2NH3,反應前后氣體體積減小為生成氨氣的體積,相同條件下,氣體體積比等于氣體物質的量之比,圖象分析可知平衡狀態氨氣體積含量42%,設平衡混合氣體體積為 100,氨氣為體積42,則反應前氣體體積100+42=142,氮氣和氫氣按照1:3混合,氮氣體積=142×![]() =35.5,依據化學方程式計算反應的氮氣體積為21,平衡狀態氮氣為35.5﹣21=14.5,則氮氣體積分數為14.5%;(4)分析流程合成氨放熱通過Ⅳ熱交換器加熱反應混合氣體,使反應達到所需溫度,提高合成氨原料總轉化率,依據平衡移動原理分析,分離出氨氣促進平衡正向進行,把平衡混合氣體中氮氣和氫氣重新循環使用,提高原理利用率;
=35.5,依據化學方程式計算反應的氮氣體積為21,平衡狀態氮氣為35.5﹣21=14.5,則氮氣體積分數為14.5%;(4)分析流程合成氨放熱通過Ⅳ熱交換器加熱反應混合氣體,使反應達到所需溫度,提高合成氨原料總轉化率,依據平衡移動原理分析,分離出氨氣促進平衡正向進行,把平衡混合氣體中氮氣和氫氣重新循環使用,提高原理利用率;


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】Be(OH)2是兩性的,跟強酸反應時生成Be2+,跟強堿反應時生成BeO22—。現有三份等物質的量濃度、等體積的BeCl2、MgCl2、AlCl3溶液(配制時均加入少量鹽酸),現將一定濃度的NaOH溶液,分別滴入三種溶液中至過量,NaOH溶液的體積x(mL)與生成沉淀的物質的量y(mL)的關系如下圖所示,則與BeCl2、MgCl2、AlCl3三種溶液對應的圖像正確的是
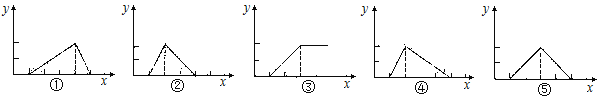
A.③②① B.②③④ C.③⑤④ D.⑤③①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】

(1)該硫酸的物質的量濃度是____________mol/L。
(2)某化學興趣小組進行硫酸性質的實驗探究時,需用490 mL 4.6 mol/L的稀硫酸,則要量取該硫酸的體積為_____________mL。
(3)按題(2)的要求配制溶液時,右圖中肯定不需要用到的實驗儀器是________(填儀器序號),所需的玻璃儀器中,除量筒、燒杯、玻璃棒和膠頭滴管之外,還需要_______________(填儀器名稱)。

(4)在下列配制過程示意圖中,有錯誤的是(填寫序號) __________________。

(5)在配制4.6 mol/L的稀硫酸的過程中,下列情況會引起硫酸溶液物質的量濃度偏高的是 。
A.未經冷卻趁熱將溶液注入容量瓶中 |
B.容量瓶洗滌后,未經干燥處理 |
C.定容時仰視觀察液面 |
D.搖勻后發現液面低于刻度線繼續加水定容 |
(6)用配制好的4.6 mol/L的稀硫酸溶液,再來配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液_______________ml.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 向海水中加入凈水劑明礬可使海水淡化
B. 合成纖維、光導纖維都屬于有機高分子材料
C. 利用加熱的方法殺死人體內感染的埃博拉病毒
D. “霧”是微小水滴或冰晶組成的氣溶膠系統,“霾”中的灰塵對大氣中的有害物質起吸附作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與科學、技術、社會、環境密切相關。下列有關說法正確的是( )
A. 用O3替代Cl2做飲用水消毒劑
B. 包裝用材料聚乙烯和聚氯乙烯都屬于烴
C. 人造纖維、合成橡膠和光導纖維都屬于有機高分子化合物
D. 氫氧燃料電池、硅太陽能電池中都利用了原電池原理
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于蛋白質的敘述中不正確的是( )
A. 人工合成具有生命活力的蛋白質—結晶牛胰島素是我國科學家在1965年首次合成的
B. 在蛋白質溶液中加入飽和硫酸銨溶液,蛋白質析出,加水,不溶解
C. 重金屬鹽類能使蛋白質凝結,所以誤食重金屬鹽類能使人中毒
D. 濃硝酸濺在皮膚上能使皮膚變黃,這是由于濃硝酸和蛋白質發生了顏色反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用雙線橋法標出下列反應中電子轉移的方向和數目,并填空。
(1)Cl2+SO2+2H2O=H2SO4+2HCl氧化劑是____________;被氧化的物質是___________。
(2)3NO2+2H2O=2HNO3+NO,氧化產物是__________,氧化劑與還原劑的質量比為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com