
【題目】連二亞硫酸鈉(Na2S2O4),也稱為保險粉,Na2S2O4易溶于水,難溶于乙醇,具有極強的還原性,易被空氣氧化,在堿性介質中穩定。其陰離子的結構如圖所示: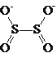 。某科研小組制備并探究其性質。
。某科研小組制備并探究其性質。
Ⅰ.制備Na2S2O4(加熱等輔助儀器略去)
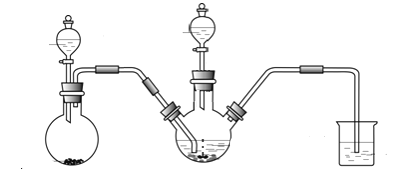
(1)Na2S2O4中硫元素的化合價為_______。
(2)連接好裝置后,檢查其氣密性良好的操作是____________________。
(3)添加藥品、再次連接好裝置:
①第一步,將A中生成的氣體通往B中進行反應,在B裝置生成連二亞硫酸鋅的化合反應方程式為__________;
②第二步,加入NaOH溶液,于28~35℃下反應生成Na2S2O4,該步反應的離子方程式為_____________。
第三步,將第二步的混合物過濾,并向濾液中加入固體NaCl,冷卻至20℃,便有Na2S2O4晶體析出。
③第四步,將第三步所得混合物經________(填操作名稱)、________(填寫 “水”或“乙醇”)洗滌,得到純凈的Na2S2O4晶體。
(4)裝置C的作用是 _______________。
Ⅱ.探究Na2S2O4的穩定性
(5)隔絕空氣加熱Na2S2O4固體完全分解得到固體產物Na2SO3、Na2S2O3和SO2,但科研小組沒有做到完全隔絕空氣,得到的固體產物中還含有Na2SO4。請設計實驗證明該分解產物中含有Na2SO4。實驗方案是______________。(可選試劑:稀鹽酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
【答案】+3 關閉分液漏斗的旋塞,將C裝置的導管插入燒杯中的水面下,微熱燒瓶,導管口有氣泡產生,停止加熱,導管口形成一段水柱,則氣密性良好 2SO2 + Zn = ZnS2O4 Zn2+ + 2OH- ![]() Zn(OH)2↓ 過濾 乙醇 吸收SO2,防止污染空氣;隔離空氣,防止空氣中的O2將產物氧化 取少量產品溶于足量稀鹽酸,靜置,取上層清液(或過濾,取濾液),滴加BaCl2溶液,若出現沉淀則說明含有Na2SO4雜質
Zn(OH)2↓ 過濾 乙醇 吸收SO2,防止污染空氣;隔離空氣,防止空氣中的O2將產物氧化 取少量產品溶于足量稀鹽酸,靜置,取上層清液(或過濾,取濾液),滴加BaCl2溶液,若出現沉淀則說明含有Na2SO4雜質
【解析】
⑴根據化合價分析,鈉為+1價,O為-2價,Na2S2O4中硫元素的化合價為+3價,故答案為+3;
⑵連接好裝置后,檢查其氣密性良好的操作是關閉分液漏斗的旋塞,將C裝置的導管插入燒杯中的水面下,微熱燒瓶,導管口有氣泡產生,停止加熱,導管口形成一段水柱,則氣密性良好,故答案為關閉分液漏斗的旋塞,將C裝置的導管插入燒杯中的水面下,微熱燒瓶,導管口有氣泡產生,停止加熱,導管口形成一段水柱,則氣密性良好;
⑶添加藥品、再次連接好裝置:
①第一步,將A中生成的氣體通往B中進行反應,在B裝置生成連二亞硫酸鋅的化合反應方程式為2SO2 + Zn = ZnS2O4,故答案為2SO2 + Zn = ZnS2O4;
②第二步,加入NaOH溶液,于28~35℃下反應生成Na2S2O4,主要是發生復分解反應生成沉淀,該步反應的離子方程式為Zn2+ + 2OH- ![]() Zn(OH)2↓,
Zn(OH)2↓,
故答案為Zn2+ + 2OH- ![]() Zn(OH)2↓;
Zn(OH)2↓;
第三步,將第二步的混合物過濾,并向濾液中加入固體NaCl,冷卻至20℃,便有Na2S2O4晶體析出。
③第四步,由于有Na2S2O4晶體析出,因此將第三步所得混合物經過濾、由于Na2S2O4易溶于水,不能用水洗滌,只能用乙醇洗滌,得到純凈的Na2S2O4晶體,故答案為過濾;乙醇;
⑷由于反應中二氧化硫不能完全反應,因此裝置C的作用是吸收SO2,防止污染空氣;隔離空氣,防止空氣中的O2將產物氧化,故答案為吸收SO2,防止污染空氣;隔離空氣,防止空氣中的O2將產物氧化;
⑸隔絕空氣加熱Na2S2O4固體完全分解得到固體產物Na2SO3、Na2S2O3和SO2,但科研小組沒有做到完全隔絕空氣,得到的固體產物中還含有Na2SO4。請設計實驗證明該分解產物中含有Na2SO4。要將亞硫酸鈉溶液全部與鹽酸反應,將得到的溶液再加入氯化鋇反應,實驗方案是取少量產品溶于足量稀鹽酸,靜置,取上層清液(或過濾,取濾液),滴加BaCl2溶液,若出現沉淀則說明含有Na2SO4雜質,故答案為取少量產品溶于足量稀鹽酸,靜置,取上層清液(或過濾,取濾液),滴加BaCl2溶液,若出現沉淀則說明含有Na2SO4雜質。


科目:高中化學 來源: 題型:
【題目】對于平衡體系mA(g)+nB(g)![]() pC(g)+qD(g) △H<0。下列結論中正確的是
pC(g)+qD(g) △H<0。下列結論中正確的是
A.若溫度不變,將容器的體積縮小到原來的一半,此時A的濃度為原來的1.8倍,則m+n<p+q
B.反應達平衡時,A、B的轉化率一定相等
C.若m+n=p+q,則往含有amol氣體的平衡體系中再加入amol的B,達到新平衡時,氣體的總物質的量等于2amol
D.若溫度不變,壓強增大到原來的2倍,達到新平衡時,總體積一定比原來的![]() 要小
要小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組同學為探究同周期或同主族元素性質的遞變規律,設計了如下系列實驗:
Ⅰ.(1)將等質量的鉀、鈉、鎂、鋁分別投入到足量的同濃度的鹽酸中,試預測實驗結果:上述金屬中_____與鹽酸反應最劇烈,_____與鹽酸反應生成的氣體最多。
(2)向Na2S溶液中通入氯氣出現淡黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為_____________________________________。
Ⅱ.利用圖裝置來驗證同主族元素非金屬性的變化規律:
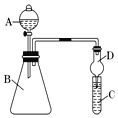
(1)要證明非金屬性:Cl>I,在A中加濃鹽酸,B中加KMnO4(KMnO4與濃鹽酸常溫下反應生成氯氣),C中加淀粉碘化鉀混合溶液,觀察到C中溶液_____________的現象,即可證明。干燥管D的作用是_________________。從環境保護的角度考慮,此裝置尚缺少尾氣處理裝置,可用_____溶液吸收尾氣。
(2)要證明非金屬性:C>Si,在A中加鹽酸,B中加CaCO3,C中加Na2SiO3溶液,應在B、D之間增加一個盛有足量_____(選填下列字母:A.濃鹽酸 B.濃NaOH溶液C.飽和Na2CO3溶液 D.飽和NaHCO3溶液)的洗氣裝置。改進后C中發生反應的化學方程式是__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增大,m、p、q、r、s是由這些元素組成的二元化合物,常溫常壓下r為日常生活中最常見的液體,其余均為無色氣體,m的摩爾質量為p的2倍,n是元素Y的單質,是綠色植物光合作用產生的無色氣體,p能使濕潤的紅色石蕊試紙變藍,q能使品紅溶液褪色。上述物質之間的轉化關系如圖所示。下列說法正確的是
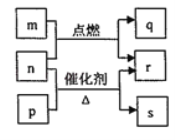
A.m與r中所含化學鍵類型相同
B.r的沸點高于p的沸點
C.m與q混合沒有明顯現象
D.q與s均為酸性氧化物,m的水溶液顯酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有下列各組物質:
①O2和O3②CH2=CHCH3和CH2=CH-CH=CH2③![]() 和
和![]() ④
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3⑥
⑤CH3CH2CH3和CH3C(CH3)3⑥![]() 和質量數為238中子數為146的原子⑦
和質量數為238中子數為146的原子⑦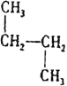 和
和![]() ⑧
⑧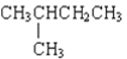 和CH3(CH2)3CH3
和CH3(CH2)3CH3
屬于同系物的是______;填序號,下同屬于同分異構體的是______;屬于同位素的是______;屬于同素異形體的是______;屬于同種物質的是______。
(2)寫出下列有機物的官能團的名稱.
①![]() ____________;②
____________;②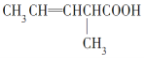 ___________;
___________;
(3)①由乙烯制一氯乙烷;②乙烯使酸性高錳酸鉀溶液褪色;③乙烷在光照下與氯氣反應;④乙烯使溴水褪色。在以上反應中,屬于取代反應的是______(填序號,下同);屬于加成反應的是______;屬于氧化反應的是______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】安徽省具有豐富的銅礦資源,請回答下列有關銅及其化合物的問題。
(1)焰火中的綠色是銅的焰色,基態銅原子在灼燒時外圍電子發生了________而變為激發態。
(2)新型農藥松脂酸銅具有低殘留的特點,圖是松脂酸銅的結構簡式。請分析
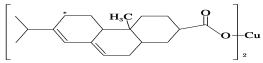
1個松脂酸銅中π鍵的個數為________;加“*”碳原子的雜化方式為________。
(3)黃銅礦在冶煉的時候會產生副產品SO2,SO2分子的幾何構型為________,比較第一電離能:S________O(填“>”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液僅含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的4種離子,所含離子的物質的量均為
中的4種離子,所含離子的物質的量均為![]() 。若向該溶液中加入過量的稀硫酸,有氣泡產生,且溶液中陰離子種類不變(不考慮水的電離和離子的水解)。下列說法錯誤的是( )
。若向該溶液中加入過量的稀硫酸,有氣泡產生,且溶液中陰離子種類不變(不考慮水的電離和離子的水解)。下列說法錯誤的是( )
A.該溶液中所含的離子是:![]() 、
、![]() 、
、![]() 、
、![]()
B.若向該溶液中加入過量的稀硫酸和![]() 溶液,溶液顯血紅色
溶液,溶液顯血紅色
C.若向該溶液中加入過量的稀硫酸,產生的氣體遇空氣能變成紅棕色
D.若向該溶液中加入足量的![]() 溶液,充分反應后,過濾、洗滌、灼燒,最終所得固體的質量為
溶液,充分反應后,過濾、洗滌、灼燒,最終所得固體的質量為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】精制氯化鉀在工業上可用于制備各種含鉀的化合物,完成下列填空,工業氯化鉀中含有![]() 、
、![]() 、
、![]() 等雜質離子,可按如下步驟進行精制,完成各步內容:
等雜質離子,可按如下步驟進行精制,完成各步內容:
①溶解;②加入試劑至![]() 、
、![]() 沉淀完全,煮沸;③____________;④加入鹽酸調節
沉淀完全,煮沸;③____________;④加入鹽酸調節![]() ;⑤____________(除
;⑤____________(除![]() );⑥蒸干灼燒。步驟②中,依次加入的沉淀劑是
);⑥蒸干灼燒。步驟②中,依次加入的沉淀劑是![]() 、______、______。證明
、______、______。證明![]() 已沉淀完全的操作是____________。
已沉淀完全的操作是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是幾種常見的化學電源示意圖,有關說法不正確的是( )
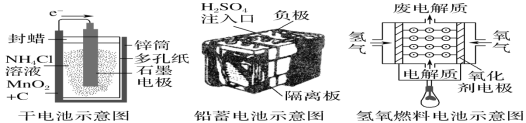
A.上述電池分別屬于一次電池、二次電池和燃料電池
B.干電池在長時間使用后,鋅筒被破壞
C.鉛蓄電池工作過程中,正、負電極質量均減輕
D.氫氧燃料電池是一種具有廣闊應用前景的綠色電源
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com