
【題目】某種合金由鎂,鋁,銅,鐵中的兩種或兩種以上組成,取該合金10.0g,放入足量H2SO4溶液,收集到標準狀況下的H210.08L;另取該合金10.0g,放入足量NaOH溶液中,收集到標準狀況下的H28.96L。
(1)試據此判斷,合金中一定含有的元素是_______________。(寫元素符號);
(2)該合金與NaOH溶液反應的離子方程式:_________________________________。
(3)該合金組成可能是________________。(寫出所有可能)
【答案】 Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ ①Al Fe ②Al Mg Cu ③Al Mg Fe Cu
【解析】(1)鎂、鋁、銅、鐵這四中金屬單質中,能和NaOH反應的只有鋁,所以合金中一定含有Al元素。故答案為:Al;
(2)Al 與NaOH反應生成氫氣,且有水參與,方程式為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Al 與NaOH反應生成H28.96L,即0.4mol,根據關系式2Al~3H2↑
n(Al)= ![]() ,m(Al)=
,m(Al)= ![]() =7.2g,則合金中其他金屬的總質量為10-7.2=2.8g。等量的鋁與H2SO4、與NaOH反應過程中,失去的電子數相同,所產生的H2也是相同的,所以合金與H2SO4反應,2.8g其他金屬所產生的H2體積為10.08-8.96=1.12L,即0.05mol。
=7.2g,則合金中其他金屬的總質量為10-7.2=2.8g。等量的鋁與H2SO4、與NaOH反應過程中,失去的電子數相同,所產生的H2也是相同的,所以合金與H2SO4反應,2.8g其他金屬所產生的H2體積為10.08-8.96=1.12L,即0.05mol。
2.8g金屬產生1.12L氫氣,提供的電子為0.05mol×2=0.1mol。此時利用平均值的思想來分析,提供1mol電子需要金屬的平均質量為28g。
①Mg反應生成Mg2+,提供1mol電子需要Mg的質量為![]() ;
;
②Cu與稀硫酸不反應,可以理解為提供1mol電子需要Cu的質量為無窮大;
③Fe反應生成Fe2+,提供1mol電子需要Fe的質量為![]() 。
。
所以,合金中除Al之外另外的金屬,第一種可能性為:只有Fe;第二種可能性有Mg和Cu,一個小于28g,一個大于28g,以某種比例混合可以等于28;第三種可能性是Fe、Mg、Cu三者都有。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是
A.糖類化合物也可稱為碳水化合物B.油脂在堿性條件下能發生水解反應
C.醫用消毒酒精中乙醇的濃度為95%D.用灼燒的方法可以區分蠶絲和人造纖維
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列每組分別給出了兩個量,不可以求出相應物質的量的是
A | B | C | D |
物質微粒數 | 溶液的質量分數 | 標準狀況下氣體的摩爾體積 | 物質的質量 |
阿伏加德羅常數 | 溶液體積 | 標準狀況下氣體的體積 | 物質的摩爾質量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NaOH溶液吸收煙氣中的SO2,將所得的Na2SO3溶液進行電解,可循環再生NaOH,同時得到H2SO4,其原理如圖所示(電極材料為石墨)。下列有關敘述不正確的是( )
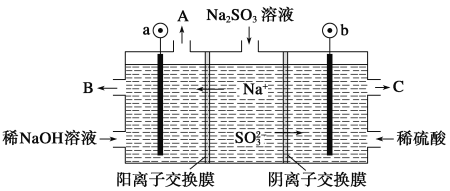
A.圖中a極連接電源的負極
B.A口放出的物質是氫氣,C口放出的物質是氧氣
C.b極電極反應式為:SO32--2e-+H2O===SO42-+2H+
D.電解過程中陰極區堿性明顯增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綜合利用海水資源可以制備氯化銨、純堿、金屬鎂等物質,其流程如下:

(1)反應①~⑤中,屬于氧化還原反應的是______________(填序號)。
(2)寫出反應②的離子方程式__________________________________________________。
(3)X溶液中的主要陽離子是Na+和____________。
(4)粗鹽中含有Na2SO4、MgCl2、CaCl2等雜質,為制得純凈的NaCl晶體,操作如下:①溶解;②依次加入過量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③_____;④加適量鹽酸;⑤_____(請補全缺少的實驗步驟)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com