
【題目】在Cl2+H2O=HCl+HClO中,水是( )
A.只作氧化劑B.只作還原劑
C.既作氧化劑又作還原劑D.既不是氧化劑又不是還原劑
 陽光課堂同步練習系列答案
陽光課堂同步練習系列答案科目:高中化學 來源: 題型:
【題目】甲烷在加熱條件下可還原氧化銅,氣體產物除水蒸氣外,還有碳的氧化物。某化學小組利用如圖裝置探究其反應產物。

[查閱資料]
①CO能與銀氨溶液反應:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3
②Cu2O為紅色,不與Ag+反應,能發生反應:Cu2O+2H+=Cu2++Cu+H2O
(1)裝置A中反應的化學方程式為________________________________________。
(2)按氣流方向各裝置從左到右的連接順序為A→____________。(填字母編號,裝置不重復使用)
(3)實驗中滴加稀鹽酸的操作為____________________________________。
(4)已知氣體產物中含有CO,則裝置C中可觀察到的現象是____________________;裝置F的作用為_____________________。
(5)當反應結束后,裝置D處試管中固體全部變為紅色。
①設計實驗證明紅色固體中含有Cu2O:___________________________________________。
②為了證明紅色固體中是否含有Cu,甲同學設計如下實驗:向少量紅色固體中加入適量0.1mol/L AgNO3溶液,發現溶液變藍,據此判斷紅色固體中含有Cu。乙同學認為該方案不合理,欲證明甲同學的結論,還需增加如下對比實驗,完成表中內容。
實驗步驟(不要求寫出具體操作過程) | 預期現象和結論 |
______________ | 若觀察到溶液不變藍,則證明紅色固體中含有Cu;若觀察到溶液變藍,則不能證明紅色固體中含有Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在研究Fe與H2SO4的反應時,進行了如下實驗。
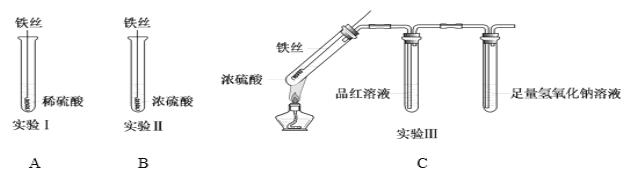
(1)實驗Ⅰ中,鐵與稀硫酸反應的離子方程式為__________________________________。
(2)實驗Ⅱ中,鐵絲表面迅速變黑,反應很快停止,其原因是________________________________。
(3)實驗Ⅲ中,加熱后產生大量氣體,中間試管中品紅溶液的紅色褪去,最終未檢測到可燃性氣體。最后裝NaOH溶液試管中反應的離子方程式是_________________________________。
(4)對比實驗Ⅰ、Ⅱ和Ⅲ,同學們得出以下結論:
①濃硫酸和稀硫酸都具有氧化性,但原因不同。濃硫酸的氧化性源于+6價的硫元素,稀硫酸的氧化性源于______。
②造成反應多樣性的主要因素有________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水是生命之源,它與我們的生活密切相關。在化學實驗和科學研究中,水也是一種常用的試劑。
(1)水分子中氧原子在基態時核外電子排布式為________________________;
(2)寫出與H2O分子互為等電子體的微粒___________________(填1種即可)。
(3)水分子在特定條件下容易得到一個H+,形成水合氫離子(H3O+)。下列對上述過程的描述不合理的是___________________
A.氧原子的雜化類型發生了改變 B.微粒的形狀發生了改變
C.微粒的化學性質發生了改變 D.微粒中的鍵角發生了改變
(4)下列是鈉、碘、金剛石、干冰、氯化鈉晶體的晶胞圖(未按順序排序)。與冰的晶體類型相同的是___________________(請用相應的編號填寫)

(5)在冰晶體中,每個水分子與相鄰的4個水分子形成氫鍵(如圖所示),已知冰的升華熱是51 kJ/mol,除氫鍵外,水分子間還存在范德華力(11 kJ/mol),則冰晶體中氫鍵的“鍵能”是_________kJ/mol;
(6)將白色的無水CuSO4溶解于水中,溶液呈藍色,是因為生成了一種呈藍色的配合離子。請寫出生成此配合離子的離子方程式:____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純度晶硅是典型的無機非金屬材料,又稱“半導體”材料,它的發現和使用曾引起計算機的一場 “革命”。它可以按下列方法制備:
![]()
下列說法正確的是
A. 步驟①的化學方程式為:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步驟①②③中每生成或反應1mol Si,轉移2mol電子
C. SiHCl3(沸點33.0℃)中含有少量的SiCl4(沸點67.6℃),通過蒸餾(或分餾)可提純SiHCl3
D. 二氧化硅能與氫氟酸反應,而硅不能與氫氟酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學研究性學習小組的同學在學習了氨的性質后討論:運用類比的思想,既然氨氣具有還原性,能否像H2那樣還原CuO呢?他們設計實驗制取氨氣并探究上述問題。請你參與該小組的活動并完成下列研究:
(一)制取氨氣
(1)寫出實驗制取氨氣的化學方程式______________________________________;
(2)在實驗室中,還可以用濃氨水與____________(填寫一種試劑)快速制取少量氨氣;
(二)該小組中某同學設計了下圖所示的實驗裝置(夾持及尾氣處理裝置未畫出),探究氨氣的還原性:
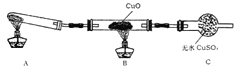
(1)該裝置在設計上有一定缺陷,為保證實驗結果的準確性,對該裝置的改進措施是____。
(2)利用改進后的裝置進行實驗,觀察到CuO變為紅色物質,無水CuSO4變藍色,同時生成一種無污染的氣體。寫出氨氣與CuO反應的化學方程式:_________________________
(三)問題討論
(1)有同學認為:NH3與CuO反應生成的紅色物質中可能含有Cu2O。已知:Cu2O是一種堿性氧化物;在酸性溶液中,Cu+的穩定性比Cu2+差(Cu+ ![]() Cu+Cu2+)。請你設計一個簡單的實驗檢驗該紅色物質中是否含有Cu2O_______________________________________________。
Cu+Cu2+)。請你設計一個簡單的實驗檢驗該紅色物質中是否含有Cu2O_______________________________________________。
(2)在解決了問題(1)后,又有同學提出:Cu2O與CuO的熱穩定性哪個更強?于是他們進行了如下實驗:取98 gCu(OH)2固體,加熱至80℃~100℃時,得到黑色固體粉末,繼續加熱到1000℃以上,黑色粉末全部變為紅色粉末A。冷卻后稱量,A的質量為72g。據此可推得,A的化學式為____________。由此,得到的結論是:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子一定能大量共存的是( )
A. 加入鋁粉有氫氣產生的溶液中:Na+、K+、SO42-、Cl-、HCO3-
B. 含有大量硝酸根離子的溶液中:H+、Fe2+、SO42-、Cl-
C. 常溫下,![]() =1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
=1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
D. 常溫下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組為了探究一種無機礦物鹽X(僅含四種元素)的組成和性質,設計并完成了如下實驗:

另取10.80 g X在惰性氣流中加熱至完全分解,得到6.40 g固體1。請回答如下問題:
(1)畫出白色沉淀1中金屬元素的原子結構示意圖:________________。寫出氣體甲的電子式:________。
(2)X的化學式是________,在惰性氣流中加熱X至完全分解的化學方程式為____________。
(3)白色沉淀2在空氣中變成紅褐色沉淀的原因是______________________________(用化學反應方程式表示)。
(4)一定條件下,氣體甲與固體1中的某種成分可能發生氧化還原反應,寫出一個可能的化學反應方程式:___________,并設計實驗方案驗證該反應的產物:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以赤鐵礦(主要成分為60.0%Fe2O3,雜質有3.6%FeO,Al2O3,MnO2,CuO等)為原料制備高活性鐵單質的主要生產流程如圖所示:
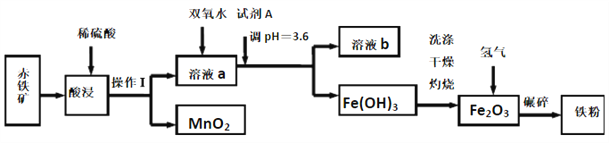
已知部分陽離子以氫氧化物形式完全沉淀時溶液的pH如表所示, 請回答下列問題:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
(1)將操作Ⅰ后所得的MnO2與KClO3、KOH溶液混合共熱,可得到K2MnO4,此反應的化學方程式是____________________________。
(2)將pH控制在3.6的目的是_______。已知25℃時,Ksp[Cu(OH)2]=2×10-20,該溫度下反應Cu2++2H2O![]() Cu(OH)2+2H+的平衡常數K=_______。
Cu(OH)2+2H+的平衡常數K=_______。
(3)加入雙氧水時反應的離子方程式為_______。
(4)利用氨氣在500℃以上分解得到的氮原子滲透到鐵粉中可制備氮化鐵(FexNy),若消耗氨氣17.0g,消耗赤鐵礦石1Kg,寫出該反應完整的化學方程式:_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com