
【題目】下列實驗方案中,能達到相應實驗目的的是
A.方案①用于分離I2和NH4I固體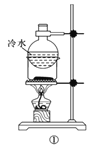
B.方案②用于比較CuSO4和MnO2的催化活性
C.方案③用于測定中和熱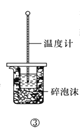
D.方案④用于比較醋酸和硼酸的酸性強弱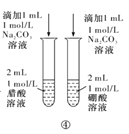
 特高級教師點撥系列答案
特高級教師點撥系列答案科目:高中化學 來源: 題型:
【題目】下列解釋事實的化學用語不正確的是
A. 閃鋅礦(ZnS)經CuSO4溶液作用后,轉化為銅藍(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH約為3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 電解NaCl溶液,陰極區溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 鋼鐵發生吸氧腐蝕,負極反應為:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】早期發現的一種天然二十面體準晶顆粒由Al、Cu、Fe三種金屬元素組成,據此回答下列問題。
(1)準晶是一種無平移周期序,但有嚴格準周期位置序的獨特晶體,可通過___________方法區分晶體、準晶體和非晶體;
(2)CuO在高溫時分解為O2和Cu2O,請從陽離子的結構來說明在高溫時,Cu2O比CuO更穩定的原因是__________________________;Cu2O為半導體材料,在其立方晶胞內部有4個氧原子,其余氧原子位于面心和頂點,則該晶胞中有_______個銅原子;
(3)經驗規律告訴我們,當成鍵的兩個原子電負性χ的差值Δχ大于1.7時,原子間一般形成的是離子鍵;Δχ小于1.7時,原子間一般形成的是共價鍵。已知χ(Fe)=1.8,χ(Cl)=3.1,據此推斷化合物FeCl3中Fe-Cl鍵的共用電子對偏向______原子(填名稱),FeCl3屬于__________(填“共價化合物”或“離子化合物”);
(4)某種磁性氮化鐵的結構如圖所示,N隨機排列在Fe構成的正四面體空隙中。正六棱柱底邊長為a cm,高為c cm,阿伏加德羅常數的值為NA,則該磁性氮化鐵的晶體密度為__________ g/cm3(用代數式表示)。
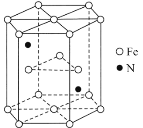
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝苯地平H是一種治療高血壓的藥物;其一種合成路線如下:
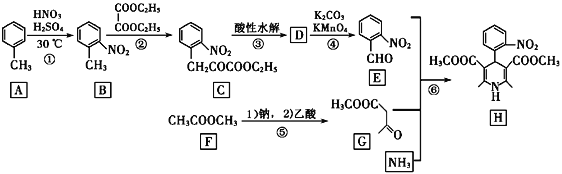
已知:酯分子中的a-碳原子上的氫比較活潑,使酯與酯之間能發生縮合反應。
![]()
回答下列問題:
(1)B的化學名稱為________.
(2)②的反應類型是________.
(3)D的結構簡式為________.
(4)H的分子式為________.
(5)反應①的化學方程式為________.
(6)已知M與G互為同分異構體,M在一定條體下能發生銀鏡反應,核磁共振氫譜顯示有4組峰,峰面積之比為1:1:2:4,寫出M的一種可能的結構簡式________.
(7)拉西地平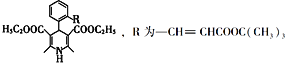 也是一種治療高血壓藥物,設以乙醇和
也是一種治療高血壓藥物,設以乙醇和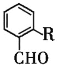 為原料制備拉西地平的合成路線(無機試劑任選)。________________________
為原料制備拉西地平的合成路線(無機試劑任選)。________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列裝置制備并檢驗Cl2的性質,下列有關說法正確的是( )

A.Ⅰ圖中:如果MnO2過量,濃鹽酸就可全部反應
B.Ⅱ圖中:充分光照后,量筒中剩余氣體約為10 mL(條件相同)
C.Ⅲ圖中:生成藍色的煙,若在集氣瓶中加入少量水,所得溶液呈綠色
D.Ⅳ圖中:干燥的有色布條不褪色,濕潤的有色布條能褪色,說明Cl2有漂白性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于價電子排布式為![]() 的原子的描述正確的是( )
的原子的描述正確的是( )
A.該原子核外有三種形狀不同的電子云
B.該原子核外電子共有16種不同的運動狀態
C.該原子形成的單質可與H2反應生成常溫下為液態的化合物
D.基態該原子的軌道表示式為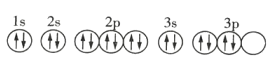
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電導率是衡量電解質溶液導電能力大小的物理量。常溫下,將相同體積的鹽酸和氨水分別加水稀釋,溶液的電導率隨加入水的體積V(H2O)變化的曲線如圖所示,下列說法正確的是
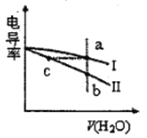
A. 曲線I表示鹽酸加水稀釋過程中溶液電導率的變化
B. a、b、c三點溶液的pH:a>b>c
C. 將a、b兩點溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀釋過程中,c(NH4+)/ c(NH3·H2O)不斷減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿斯巴甜是一種具有清爽甜味的有機化合物,結構簡式如圖所示。下列說法不正確的是( )
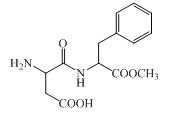
A.分子式為C14H18N2O5
B.不存在順反異構
C.能發生取代和消去反應
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z均為短周期主族元素,它們原子的最外層電子數之和為10。X與Z同族,Y最外層電子數等于X次外層電子數,且Y原子半徑大于Z。下列敘述正確的是( )
A.Y的核外電子排布式為![]()
B.熱穩定性:X的氫化物大于Z的氫化物
C.X與Z可形成離子化合物ZX
D.Y的單質與Z的單質均能溶于濃硝酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com