
【題目】已知1L某待測液中除含有0.2mol·L-1的Na+外,還可能含有下列離子中的一種或幾種:
陽離子 | K+、NH4+、Mg2+、Ba2+、 Fe3+ |
陰離子 | Cl-、Br-、CO32-、HCO3-、SO42- |
現進行如下實驗操作(每次實驗所加試劑均過量):

(1)由氣體B可確定待測液中含有的離子是______________。
(2)由沉淀D和沉淀E可以判斷待測液中一定含有______離子,據此可以排除的離子是________。
(3)由白色沉淀B可確定待測液中含有的離子是__________________。
(4)某同學讀圖后,認為待測液一定不含溴離子,他判斷的依據是_________________。
(5)綜合分析,待測液中K+的最小濃度為____________________。
【答案】NH4+ CO32-、SO42- Mg2+、Ba2+、Fe3+ HCO3- 溶液B通入氯氣,溶液呈淺黃綠色或溶液B 滴加硝酸酸化硝酸銀溶液,出現白色沉淀 0.1mol·L-1
【解析】
(1)由濾液A加入NaOH反應生成氣體B,則B肯定為NH3,則待測液中含有的離子是NH4+,n(NH4+)=n(NH3)=0.1mol;(2)沉淀A部分溶解于稀硝酸中,測液中一定含有CO32-、SO42-,據此可以排除Mg2+、Ba2+、Fe3+;(3)反應的離子方程式為:HCO3-+OH-+Ba2+=BaCO3↓+H2O;確定待測液中含有的離子是HCO3-,n(BaCO3)=n(HCO3-)=19.7g/197g/mol=0.1mol;(4)待測液一定不含溴離子,因為溶液B通入氯氣,溶液呈淺黃綠色或溶液B滴加硝酸酸化硝酸銀溶液,出現白色沉淀;(5)因硫酸鋇質量為11.65g,n(BaSO4)=n(SO42-)=11.65g/233g/mol=0.05mol,碳酸鈣的質量為10.0g,n(CaCO3)=n(CO32--)=10.0g/100g/mol=0.1mol,由以上分析可知,Na+物質的量濃度為0.2 mol·L-1、NH4+其物質的量濃度為0.1mol·L-1、CO32-物質的量濃度為0.1 mol·L-1、HCO3-物質的量濃度為0.1 mol·L、SO42-物質的量濃度為0.05 mol·L-1、Br-物質的量濃度為0 mol·L-1、Cl-物質的量濃度由K+的濃度確定,故是未知;根據電荷守恒,若溶液中無Cl-則K+的物質的量濃度為0.1mol·L-1,若含有Cl-則K+的物質的量濃度最小為0.1mol·L-1。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成兩等份。向其中一份中逐漸加入銅粉,最多能溶解19.2 g(己知硝酸只被還原為NO氣體)。向另一份中逐漸加入鐵粉,產生氣體的量隨鐵粉質量增加的變化如下圖所示。下列分析或結果錯誤的是( )
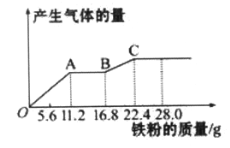
A. 第二份溶液中最終溶質為FeSO4
B. 原混合酸中NO3-物質的量為0.4mol
C. OA段產生的是NO,AB段的反應為Fe+2Fe3+=3Fe2+,BC段產生氫氣
D. 取20 mL原混合酸加水稀釋至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關原電池的說法不正確的是( )
A.是一種將化學能轉換成電能的裝置B.較活潑的金屬做電池的負極
C.電池負極發生氧化反應D.溶液中陰離子移向正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表中的前四周期,兩兩相鄰的5種元素如圖所示,若B元素的核電荷數為a。下列說法正確的是( )
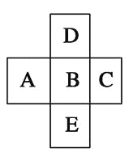
A. B、D的原子序數之差可能為2
B. E、B的原子序數之差可能是8、18或32
C. A、E的原子序數之差可能是7
D. 5種元素的核電荷總數之和可能為5a+10
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】其他條件不變時,能使反應速率加快的是 ( )
A. 對于反應Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大體系的壓強
B. 對于反應N2(g)+3H2(g)![]() 2NH3(g),容器體積固定不變時,充入N2
2NH3(g),容器體積固定不變時,充入N2
C. 對于反應N2(g)+3H2(g)![]() 2NH3(g),容器體積固定不變時,充入Ar
2NH3(g),容器體積固定不變時,充入Ar
D. 對于反應N2(g)+3H2(g)![]() 2NH3(g),容器氣體壓強不變時,充入Ar
2NH3(g),容器氣體壓強不變時,充入Ar
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】李克強總理在《2018年國務院政府工作報告》中強調“今年二氧化硫、氮氧化物排放量要下降3%。”研究煙氣的脫硝(除NOx)、脫硫(除SO2)有著積極的環保意義。
Ⅰ. 汽車排氣管上安裝“催化轉化器”,其反應的熱化學方程式為:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃時,將等物質的量的NO和CO充入容積為2L的密閉容器中,若溫度和體積不變,反應過程中(0~15min) NO的物質的量隨時間變化如圖。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃時,將等物質的量的NO和CO充入容積為2L的密閉容器中,若溫度和體積不變,反應過程中(0~15min) NO的物質的量隨時間變化如圖。
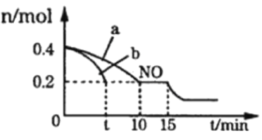
(1)圖中a、b分別表示在相同溫度下,使用質量相同但表面積不同的催化劑時,達到平衡過程中n (NO)的變化曲線,其中表示催化劑表面積較大的曲線是______(填“a”或“b”)
(2)在a曲線所示反應中,0~10min內,CO的平均反應速率v(CO)=___________;T℃時,該反應的化學平衡常數K=_____________;平衡時若保持溫度不變,再向容器中充入CO、CO2各0.2 mol,則平衡將_________移動(填“向左”、“向右”或“不”)
(3)15min時, n (NO)發生圖中所示變化,則改變的條件可能是_______(填序號)
A.充入少量CO B.將N2液化移出體系 C.升高溫度 D.加入催化劑
Ⅱ. 已知有下列反應:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化劑作用下可發生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反應,對NO2進行處理則該反應的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反應,對NO2進行處理則該反應的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某溫度下,向某恒容密閉容器中充入一定量的NH3和NO2,按照(1)的原理模擬污染物的處理。若容器中觀察到________________(填序號),可判斷該反應達到平衡狀態
A.混合氣體顏色不再改變 B. 混合氣體的密度不再改變
C.混合氣體摩爾質量不再改變 D. NH3和NO2的物質的量之比不再改變
(3)將一定比例的O2、NH3和NO2的混合氣體,勻速通入圖(a)所示裝有催化劑M的反應器中充分進行反應。
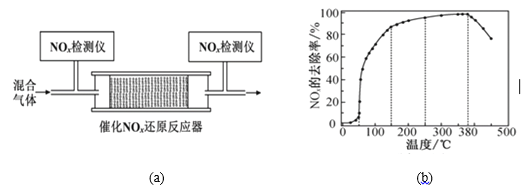
反應相同時間NOx的去除率隨反應溫度的變化曲線如圖(b)所示。已知該催化劑在100~150℃時活性最高,那么在50~250 ℃范圍內隨著溫度的升高,NOx的去除率先迅速上升后上升緩慢,其中去除率迅速上升段的主要原因是____________________________;當反應溫度高于380 ℃時,NOx的去除率迅速下降的原因可能是___________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pC類似于pH,是指極稀溶液中的溶質濃度的常用對數的負值。如某溶液中某溶質的濃度為1×10-3mol·L-1,則該溶液中該溶質的pC=-lg(1×10-3) = 3。下圖為25℃時H2CO3溶液的pC-pH圖(若離子濃度小于10-5 mol·L-1,可認為該離子不存在)。下列說法錯誤的是

A. 向Na2CO3溶液中滴加鹽酸至pH等于11時,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃時,H2CO3的一級電離平衡常數Ka1= 10-6
C. 25℃時,CO2飽和溶液的濃度是0.05 mol·L-1,其中1/5的CO2轉變為H2CO3,若此時溶液的pH 約為5,據此可得該溫度下CO2飽和溶液中H2CO3的電離度約為1%
D. 25℃時,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中離子濃度的大小為c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g) =2SO3(g)反應過程的能量變化如圖所示。已知1mol SO2(g)氧化為1mol SO3的 ΔH=—99kJ·mol-1.請回答下列問題:
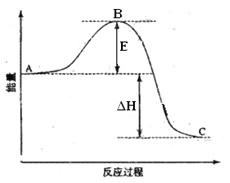
(1)圖中A、C分別表示 、 ,
E的大小對該反應的反應熱有無影響? 。該反應通常用V2O5作催化劑,加V2O5會使圖中B點升高還是降低? ,理由是
(2)圖中△H= KJ·mol-1;
(3)V2O5的催化循環機理可能為:V2O5氧化SO2時,自身被還原為四價釩化合物;四價釩化合物再被氧氣氧化。寫出該催化循環機理的化學方程式:
、
;
(4)如果反應速率υ(SO2)為0.05 mol·L-1·min-1
,則υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知單質硫的燃燒熱為296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com