
【題目】傳統接觸法制取硫酸能耗大,污染嚴將燃料電池引人硫酸生產工藝可有效解決能耗和環境污染問題,同時提供電能。以燃料電池為電源電解硫酸銅溶液的工作原理示意圖如下所示。
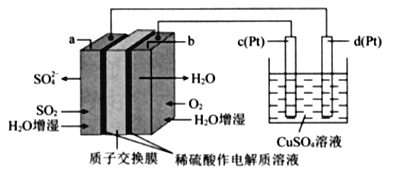
下列說法不正確的是( )
A. b極為正極,電極反應式為O2+4H++4e-=2H20
B. H+由a極通過質子交換膜向b極移動
C. 該燃料電池的總反應式為2SO2+O2+2H2O=2H2SO4
D. 若a極消耗2.24 L(標準狀況)SO2,理論上c極,有6.4g銅析出
【答案】D
【解析】
燃料電池:a端:二氧化硫生成硫酸根離子,硫元素化合價升高失電子所以a為負極,電極反應式SO2+2H2O-4e-=SO42-+4H+;b為正極,電極反應式為O2+4H++4e-=2H2O,總電極反應式2SO2+O2+2H2O=2H2SO4。電解池:c極和電源正極相連為陽極,失電子,電極反應式為4OH—-4e-=2H2O+O2↑,d極與電源負極相連為陰極,得電子,電極反應式為Cu2++2e+=Cu,總電極反應式為2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
A. b為正極,看到質子交換膜確定酸性環境,電極反應式為O2+4H++4e-=2H2O,故不選A;
B.原電池內部陽離子向正極移動,陰離子向負極移動,故不選B;
C.由上面分析可知該燃料電池的總反應為2SO2+O2+2H2O=2H2SO4,故不選C;
D.d極與電源負極相連,為陰極得電子,有銅析出,所以應該是若a電極消耗標況下2.24LSO2,理論上在d極上有6.4g銅析出,故選D;
正確答案:D。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】設阿伏加德羅常數的數值為NA,下列說法正確的是
A.1molS與足量Fe反應,轉移的電子數為3NA個
B.1.5 mol NO2與足量H2O反應,轉移的電子數為2NA個
C.常溫常壓下,46 g的NO2和N2O4混合氣體含有的原子數為3NA個
D.100 ml 0.10mol /L的氨水中,含NH3·H2O 分子0.01NA個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于同溫同壓下等質量的CO和CO2,下列敘述正確的是( )
A. 體積之比為2∶1 B. 體積之比為7∶1
C. 所含原子數之比為22∶21 D. 密度之比為11∶7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏伽德羅常數,下列說法正確的是( )
A. 標況下,11.2L氟化氫中含有的電子數5NA
B. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子總數為0.8NA
C. 100mL 0.1mol/L 的KAl(SO4)2溶液中含有的陽離子總數為0.02NA
D. 分別由H2O2和KMnO4制備等量的氧氣轉移的電子數目相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機物的說法正確的是( )
A. 甲烷和苯都是重要的化工原料,可從石油分餾中獲得
B. 淀粉、菜籽油和蛋白質都是天然高分子化合物
C. 室溫下,在水中的溶解度:乙醇大于溴乙烷
D.  苯乙烯在一定條件下可加聚反應,不可以發生取代反應
苯乙烯在一定條件下可加聚反應,不可以發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖像不符合反應Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(圖中v是速率,φ為混合物中H2的體積百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(圖中v是速率,φ為混合物中H2的體積百分含量)( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以廢舊鉛酸電池中的含鉛廢料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4為原料,制備高純PbO,實現鉛的再生利用。其工作流程如下:

(1)鉛是碳的同族元素,且比碳多4個電子層,則鉛位于元素周期表第____周期___族
(2)過程Ⅰ中,在Fe2+催化下,Pb和PbO2反應生成PbSO4的離子方程式是________________。
(3)過程Ⅰ中,Fe2+催化過程可表示為:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O ii: ……
① 寫出ii的化學方程式:_________________________。
② 請設計實驗方案可證實上述催化過程。將實驗方案補充完整。
a.向酸化的FeSO4溶液中加入__________溶液,溶液無顏色變化,再加入少量PbO2,溶液變為________色。
b.向a得到的溶液中加入___________________,溶液恢復原來的顏色。
(4)過程II中過濾操作所需要的玻璃儀器有__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示3套實驗裝置,分別回答下列問題。

(1)裝置1為鐵的吸氧腐蝕實驗。向插入碳棒的玻璃筒內滴入酚酞溶液,可觀察到碳棒附近的溶液變紅,該電極反應式為___________________。
(2)裝置2中左池為氯化鐵溶液,右池為硫酸銅溶液,一段時間后右池溶液中c(Cu2+)_________(填“增大”、“減小”或“不變”),若該裝置的鹽橋中盛裝的是NH4NO3的瓊脂溶液,則鹽橋中的_____離子(填“NH4+”或“NO3-”)向氯化鐵溶液遷移。
(3)裝置3中甲燒杯盛放100mL 0.2mol/L的NaCl溶液,乙燒杯盛放100mL 0.5mol/L的CuSO4溶液。反應一段時間后,觀察到乙燒杯的石墨電極上有氣泡生成。
①電源的M端為___極;甲燒杯中鐵電極的電極反應式為_______________。
②乙燒杯中電解反應的離子方程式為__________________________________。
③停止電解,取出Cu電極,洗滌、干燥、稱量,電極增重0.32g,甲燒杯中產生的氣體標準狀況下體積為________mL;電解后乙燒杯溶液的pH為______(假設電解前后溶液的體積不變)。
④若要將乙池設計成電解精煉銅的裝置,則乙池的石墨應改成_____(填“粗銅”或“精銅”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為原子序數依次增大的五種短周期元素,其中C為第三周期簡單離子半徑最小的元素,0.1mol·L1A、B、D的最高價氧化物對應的水化物溶液加水稀釋時溶液的pH變化情況如圖,則下列說法中不正確的是

A. C制的容器可盛裝A和D的最高價含氧酸的濃溶液
B. AE3、D2E2分子中所有原子最外層均達到8電子結構
C. B、D、E的單質或者化合物中都可能有能作漂白劑的物質
D. 工業上分別電解熔融的B與E、C與E形成的化合物制備B、C單質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com