
【題目】如圖所示的過程是目前直接利用太陽能的研究熱點。人們把通過人工光化學手段合成燃料的過程叫做人工光合作用。

(1)在上圖構想的物質和能量循環中太陽能最終轉化為____________能。
(2)人工光合作用的途徑之一就是在催化劑和光照條件下,將CO2和H2O轉化為CH3OH,該反應的化學方程式為:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定條件下,在2L密閉容器中進行上述反應,測得n(CH3OH)隨時間的變化如下表所示:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min內該反應的平均反應速率為______________________。
②能說明該反應已達到平衡狀態的是_______________。
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH) :n(O2)=2 :3
c.容器內密度保持不變
d.容器內壓強保持不變
(3)用人工光合作用得到的甲醇、氧氣和稀硫酸制作燃料電池,則甲醇應通入該燃料電池的____極(填“正”或“負”),通入氧氣的一極的電極反應式為_______________。
【答案】 熱 0.015mol·L-1·min-1 ad 負 O2 + 4H+ + 4e- = 2H2O
【解析】(1)由據圖可知,太陽能首先轉化為化學能,其次化學能轉化為熱能,故答案為:熱;
(2)①用CH3OH表示0~3 min內該反應的平均反應速率為![]() =
=![]() =0.015mol·L-1·min-1,故答案為:0.015mol·L-1·min-1;
=0.015mol·L-1·min-1,故答案為:0.015mol·L-1·min-1;
②a.v正(H2O)=2v逆(CO2)表示正逆反應速率相等,說明反應已達到平衡狀態,正確;b.n(CH3OH) :n(O2)=2 :3,不能說明物質的量是否變化,因此不能說明反應已達到平衡狀態,錯誤;c.容器的體積不變,氣體的質量不變,容器內氣體的密度始終保持不變,不能說明反應已達到平衡狀態,錯誤;d.該反應屬于氣體的物質的量發生變化的反應,容器內壓強保持不變,說明反應已達到平衡狀態,正確;故選ad;
(3)甲醇、氧氣和稀硫酸制作燃料電池,甲醇應通入該燃料電池的負極,負極電極反應式為:CH3OH+8OH--6e-═CO32-+6H2O;通入氧氣的一極為正極,電極反應式為O2 + 4H+ + 4e- = 2H2O,故答案為:負;O2 + 4H+ + 4e- = 2H2O。


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案科目:高中化學 來源: 題型:
【題目】SO2是一種酸性氧化物,溶于水生成亞硫酸。某同學對SO2的氧化性和亞硫酸的酸性進行了探究。回答下列問題:
(一)SO2的制備
該同學制備SO2的實驗裝置如下:

(1)裝置A中發生反應的化學方程式為__________________________________________。
(2)裝置C中盛有的是NaOH溶液,其作用是_________________________。
(二)驗證SO2氧化性
待裝置B中收集滿SO2后,夾緊止水夾K1和K2取下裝置 B,利用收集到的SO2驗證其氧化性。
(3)設計一種驗證SO2具有氧化性的方法:__________________________________________(要體現所使用檢驗試劑的名稱和實驗現象等要點)。
(4)將溶液R(足量)加人裝置B的儲氣瓶中可將SO2排出進入檢驗試劑中,則溶液R是________。
(三)探究H2SO3的酸性強于HClO
由于次氯酸鹽具有較強的氧化性,故不能直接將SO2通入次氯酸鹽中檢驗H2SO3的酸性強于HClO,該同學用裝置B中收集到的SO2,利用下面裝置間接地完成了驗證。

(5)裝置的連接順序為B→______________,F的作用是______________________________。
(6)可證明H2SO3的酸性強于HClO的實驗現象是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向 20mL 0.2mol/L ![]() 溶液中滴加 0.2mol/L
溶液中滴加 0.2mol/L ![]() 溶液, 相關微粒的物質的量如下圖 (其中Ⅰ代表
溶液, 相關微粒的物質的量如下圖 (其中Ⅰ代表![]() ,Ⅱ代表
,Ⅱ代表![]() ,Ⅲ代表
,Ⅲ代表![]() ),根據圖示判斷,下列說法正確的是 ( )
),根據圖示判斷,下列說法正確的是 ( )

A. ![]() 在水中的電離方程式是:
在水中的電離方程式是: ![]()
![]()
B. 當![]() =20mL 時,溶液中各離子濃度的大小順序為:
=20mL 時,溶液中各離子濃度的大小順序為: ![]()
C. 等體積等濃度的![]() 溶液與
溶液與![]() 溶液混合后,其溶液中水的電離程度比純水大
溶液混合后,其溶液中水的電離程度比純水大
D. 當![]() =30 mL 時,溶液中存在以下關系:
=30 mL 時,溶液中存在以下關系: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,用化學用語回答:
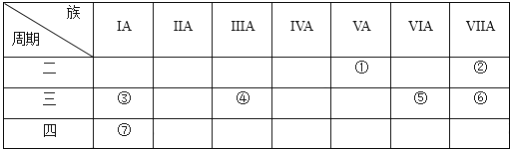
(1)②的元素符號為_________。
(2)比較元素③和⑦的原子半徑大小:③_____⑦(填“>”或“<”)。
(3)繪出元素⑤的離子結構示意圖_________________。
(4)元素①的氫化物的電子式為____________,將該氫化物通入④和⑥形成的化合物的水溶液中,發生反應的離子方程式為___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ (1)下列實驗操作或敘述正確的是_________(填字母)
A.向飽和苯酚鈉溶液中,不斷通入足量二氧化碳氣體,溶液最終呈渾濁
B.用金屬鈉檢驗無水乙醇中含有的少量水
C.在催化劑存在的條件下,苯和溴水發生反應可生成無色比水重的液體溴苯
D.向苯酚濃溶液中滴入少量濃溴水可觀察到白色的三溴苯酚沉淀
E.只用水就能鑒別苯、硝基苯、乙醇
F.將10滴溴乙烷加入1mL10%的燒堿溶液中加熱片刻后,再滴加2滴2%的硝酸銀溶液,以檢驗水解生成的溴離子
G.將銅絲彎成螺旋狀,在酒精燈上加熱變黑后,立即伸入盛有無水乙醇的試管中,完成乙醇氧化為乙醛的實驗
H.甲醛與苯酚制取酚醛樹脂的反應屬于縮聚反應
I.在蔗糖的水解液中加新制Cu(OH)2懸濁液,有磚紅色沉淀生成
Ⅱ. 1—乙氧基萘常用作香料,也可合成其他香料。實驗室制備1—乙氧基萘的過程如下:
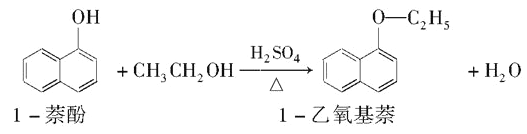
已知:1—苯酚的性質與苯酚相似,有難聞的苯酚氣味。相關物質的物理常數如下:
物質 | 相對分子質量 | 狀態 | 熔點 (℃) | 沸點 (℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 無色或黃色菱形結晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 無色液體 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 無色液體 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(1) 將72g1-萘酚溶于100mL無水乙醇中,加入5mL濃硫酸混合。將混合液置于如圖所示的容器中加熱充分反應(加熱裝置和其它加持裝置未畫出)。實驗中使用過量乙醇的原因是____________________。

(2)裝置a的作用是________________。
(3)反應結束,將三頸燒瓶中的液體倒入冷水中,經處理得到有機層。為提純產物有以下四步操作:①蒸餾;
A.③②④① B.①②③④ C.②①③④
(4)蒸餾時應該選擇_________(選填編號),操作中應控制的關鍵實驗條件為________________。

(5)實驗測得1-乙氧基萘的產量與反應時間、溫度的變化如圖所示,時間延長、溫度升高,1-乙氧基萘的產量下降的原因是____________________。

(6)用金屬鈉可檢驗1—乙氧基萘是否純凈,簡述實驗現象與結論:_______________。
(7)提純的產品經測定為73.1g,本實驗中1—乙氧基萘的產率為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.CO和氫氣在一定條件下可以合成甲醇,在一恒容的密閉容器中,由CO和![]() 合成甲醇:
合成甲醇: ![]()
(1)某溫度下,將 2.0mol CO和 6.0 mol![]() 充入2L的密閉容器中,充分反應后,達到平衡時測 得 c(CO)=0.25mol/L,則此溫度下的平衡常數 K=____(保留兩位有效數字)。
充入2L的密閉容器中,充分反應后,達到平衡時測 得 c(CO)=0.25mol/L,則此溫度下的平衡常數 K=____(保留兩位有效數字)。
(2)利用光能和光催化劑,可將CO2和![]() (g)轉化為
(g)轉化為![]() 和
和![]() 。紫外光照射時,在不同催化劑 (I、II、III)作用下,
。紫外光照射時,在不同催化劑 (I、II、III)作用下, ![]() 產量隨光照時間的變化見圖1。 則在 0~15 小時內,
產量隨光照時間的變化見圖1。 則在 0~15 小時內, ![]() 的平均生成速率I、II、III 中最大的為________(填序號)。
的平均生成速率I、II、III 中最大的為________(填序號)。

(3)以![]() 為催化劑,可以將
為催化劑,可以將![]() 和
和![]() 直接轉化成乙酸。 在不同溫度下催化劑的催化效率與乙酸的生成速率的關系見圖2。乙酸的生成速率主要取決于溫度影響的范圍是_______________。
直接轉化成乙酸。 在不同溫度下催化劑的催化效率與乙酸的生成速率的關系見圖2。乙酸的生成速率主要取決于溫度影響的范圍是_______________。
(4)25℃時, ![]() 。 該溫度下,下列說法中正確的有(填序 號)___________。
。 該溫度下,下列說法中正確的有(填序 號)___________。
a. ![]() 和
和![]() 均可做鋇餐試劑
均可做鋇餐試劑
b.同濃度的![]() 和
和![]() 混合溶液中滴加
混合溶液中滴加![]() 溶液,
溶液, ![]() 先析出
先析出
c.新制氯水中加入少量碳酸鋇固體,固體溶解,溶液漂白性增強
d. ![]() 固體加入
固體加入![]() 濃溶液,
濃溶液, ![]() 不可能轉化為
不可能轉化為![]()
Ⅱ.向 500ml 一定濃度的稀硝酸中加入 33.6g 鐵粉,固體全部溶解。 取少量反應后的溶液分別加入苯酚溶液和鐵氰化鉀試劑,各出現溶液變紫和藍色沉淀現象。再取10mL 反應后溶液于錐形瓶中,并加入硫氰化鉀試劑。用 0.500mol/L 的 H2SO3 溶液進行滴定,滴定完成時平均消耗標 準液 10.20mL。已知整個實驗過程中只產生了一種氣體,且該氣體遇空氣變紅棕色。據此回答:
(5)滴定剛開始時發生反應的離子方程式為_____________________,判斷達到滴定終點的現象是___________________;
(6)原稀硝酸溶液的濃度為____mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物的結構可用“鍵線式”表示,如:CH3CH=CHCH3可簡寫為![]() 。有機物X的鍵線式為
。有機物X的鍵線式為 ,下列說法不正確的是( )
,下列說法不正確的是( )
A. X的化學式為C8H8
B. 有機物Y是X的同分異構體,且屬于芳香烴,則Y的結構簡式為![]()
C. X能使高錳酸鉀酸性溶液褪色
D. X與足量的H2在一定條件下反應可生成環狀的飽和烴Z,Z的一氯代物有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表是A、B、C三種烴的有關信息;
A | B | C |
①能使溴的四氯化碳溶液褪色; ②比例模型為:
| ①平面型結構 ②棍模型為: | ①能使溴的四氯化碳溶液褪色; ②1mol能與2molH2在一定條件下反應生成A ③比例模型為: |
|
圖2 |
根據表中信息回答下列問題:
(1)寫出烴A與水反應的化學反應方程式_____________________;
(2)烴B分子碳碳鍵具有的特點是_______________________
(3)如圖1是烴B與液溴制取溴苯的裝置,試回答:
(a)裝置C中的現象___________________________________.
(b)裝置B的作用__________________________________.
(4)如圖2是制取烴C的裝置,試回答:
(a)為了控制生成乙炔的速率,分液漏斗中盛放的液體是_______________。
(b)滴下液體后燒瓶中發生反應生成乙炔,寫出此反應的化學方程式:_________。
(c)電石中含有硫化鈣雜質,產生H2S,PH3等氣體,為了不對乙炔性質造成干擾,應該除雜,一般選用___________洗氣。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com