
在80℃時,將0.40mo1的N2O4氣體充入2L已經抽空的固定容積的密閉容器中,發生如下反應:N2O4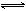 2NO2 △H>0,隔一段時間對該容器內的物質進行分析,得到如下數據:
2NO2 △H>0,隔一段時間對該容器內的物質進行分析,得到如下數據:
| t/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
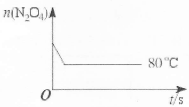
(1)0.006
(2)1.8mol/L
(3)變深
(4)D
(5)如下圖: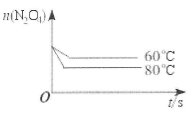
解析試題分析:(1)v(NO2)=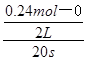 =0.006mol/(L?min);(2)起始時c(N2O4)=
=0.006mol/(L?min);(2)起始時c(N2O4)=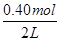 =0.20mol/L,平衡時c(NO2)=
=0.20mol/L,平衡時c(NO2)=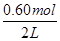 =0.30mol/L,則△c(NO2)=
=0.30mol/L,則△c(NO2)=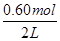 =0.30mol/L;由N2O4
=0.30mol/L;由N2O4 2NO2可知,△c(N2O4)=△c(NO2)/2=0.15mol/L,平衡時c(N2O4)=0.20mol/L—0.15mol/L=0.05mol/L;由K=
2NO2可知,△c(N2O4)=△c(NO2)/2=0.15mol/L,平衡時c(N2O4)=0.20mol/L—0.15mol/L=0.05mol/L;由K=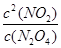 =1.8mol/L;(3)△H>0,則正反應是吸熱反應,升高溫度平衡正向移動,c(NO2)增大,則混合氣體的顏色變深;(4)平衡常數只與溫度有關,升高溫度,平衡向正反應方向移動,K增大,故選D;(5)畫圖要點:起始時n(N2O4)相同;降低溫度,反應速率減小,平衡向逆反應方向移動,則達到平衡的時間增大,且平衡時n(N2O4)增多。
=1.8mol/L;(3)△H>0,則正反應是吸熱反應,升高溫度平衡正向移動,c(NO2)增大,則混合氣體的顏色變深;(4)平衡常數只與溫度有關,升高溫度,平衡向正反應方向移動,K增大,故選D;(5)畫圖要點:起始時n(N2O4)相同;降低溫度,反應速率減小,平衡向逆反應方向移動,則達到平衡的時間增大,且平衡時n(N2O4)增多。
考點:考查化學反應速率、化學平衡、平衡常數等相關知識。


科目:高中化學 來源: 題型:填空題
煤直接燃燒的能量利用率較低,為提高其利用率,工業上將煤氣化(轉變成CO和H2)后再合成乙醇、二甲醚等多種能源。
(1)如圖所示是一種酸性燃料電池酒精檢測儀,具有自動吹氣流 量偵測與控制的功能,非常適合進行現場酒精檢測。該電池的負極反應式為______________________。
(2)煤氣化所得氣體可用于工業合成二甲醚,其反應如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同時發生副反應:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
在溫度為250 ℃、壓強為3.0 MPa時,某工廠按投料比V(H2)∶V(CO) =a進行生產,平衡時反應體系中各組分的體積分數如下表:
| 物質 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
| 體積分數 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
 CO2(g)+H2(g)的平衡常數K=________。
CO2(g)+H2(g)的平衡常數K=________。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用。試回答下列問題:
(1)高爐煉鐵是CO氣體的重要用途之一,其基本反應為:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃時,該反應的化學平衡常數K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃時,該反應的化學平衡常數K=0.263。
①溫度升高,化學平衡移動后達到新的平衡,此時平衡常數K值 (填“增大”、“減小”或“不變”);
②1 100 ℃時測得高爐中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,則在這種情況下,該反應向 進行(填“左”或“右”),判斷依據是 。
(2)目前工業上也可用CO2來生產燃料甲醇,有關反應為:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,現向體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,反應過程中測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,現向體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,反應過程中測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。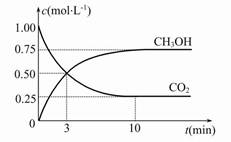
①從反應開始到平衡,氫氣的平均反應速率v(H2)= 。
②反應達到平衡后,下列措施能使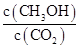 增大的是 (填符號)。
增大的是 (填符號)。
| A.升高溫度 | B.再充入H2 | C.再充入CO2 | D.將H2O(g)從體系中分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
25 ℃時,在體積為2 L的密閉容器中,氣態A、B、C的物質的量n隨時間t的變化如圖1所示,已知達到平衡后,降低溫度,A的轉化率將增大。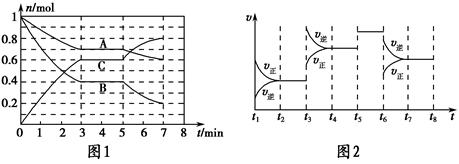
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫一碘循環分解水制氫的主要反應如下:
(1)上述循環反應的總反應可以表示為____________________;反應過程中起催化作用的物質是__________(選填編號)。
a. b.
b. c.
c. d.HI
d.HI
(2)一定溫度下,向2L密閉容器中加入1molHI(g),發生反應II, 的物質的量隨時間的變化如圖所示。0~2min內的平均反應速率
的物質的量隨時間的變化如圖所示。0~2min內的平均反應速率 _________。
_________。
(3)對反應II,在相同溫度和體積下,若開始加入的HI(g)的物質的量是原來的2倍,則以下_________也是原來的2倍(選填編號),
a.平衡常數 b.HI的平衡濃度
c.達到平衡時間 d.平衡時 的體積分數
的體積分數
(4)實驗室用鋅和稀硫酸反應制取 ,反應時溶液中水的電離平衡______移動(選填“向左”、“向右”或“不”);若加入少量下列試劑中的_____(選填編號),產生
,反應時溶液中水的電離平衡______移動(選填“向左”、“向右”或“不”);若加入少量下列試劑中的_____(選填編號),產生 的速率將增大。
的速率將增大。
a. b.
b. c.
c. d.
d.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溫度時,在一個容積為2 L的密閉容器中,X、Y、Z,三種物質的物質的量隨時間的變化曲線如圖所示。根據圖中數據,試填寫下列空白:
(1)該反應的化學方程式為______________;
(2)反應開始至2 min,用氣體Z表示的反應速率為_____;
(3)若X、Y、Z均為氣體,反應達到平衡時:
①壓強是開始時的________倍;
②若此時將容器的體積縮小為原來的 0.5倍,達到平衡時,容器內溫度將降低(容器不與外界進行熱交換),則該反應的正反應為________反應(填“放熱”或“吸熱”)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定溫度下,在2L密閉容器中NO2和O2可發生下列反應: 4NO2(g)+O2(g)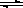 2N2O5(g)+5286 kJ已知體系中n(NO2)隨時間變化如下表:
2N2O5(g)+5286 kJ已知體系中n(NO2)隨時間變化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化學反應原理在科研和生產中有廣泛應用。
Ⅰ、如圖裝置所示,A、B中的電極為多孔的惰性電極;C、D為夾在浸有Na2SO4溶液的濾紙條上的鉑夾;電源有a、b兩極。若A、B中充滿KOH溶液后倒立于KOH溶液的水槽中。切斷K1,閉合K2、K3通直流電。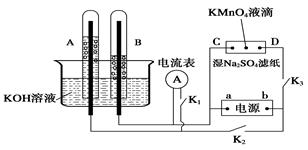
回答下列問題:
(1) a是電源的 極,寫出A中的電極反應式為_____。
(2)濕的Na2SO4濾紙條上能觀察到的現象有____________。
(3)電解一段時間后,A、B中均有氣體包圍電極,若此時切斷K2、K3,閉合K1,發現電流表的指針移動,寫出此時B中的電極反應式為 。
Ⅱ、甲醇是一種可再生能源,具有廣泛的開發和應用前景。工業上一般采用下列反應合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列數據是該反應在不同溫度下的化學平衡常數(K)。請回答下列問題:
CH3OH(g) ΔH,下表所列數據是該反應在不同溫度下的化學平衡常數(K)。請回答下列問題:
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知反應A(g)+B(g) C(g)+D(g)△H<0回答下列問題:
C(g)+D(g)△H<0回答下列問題:
(1)該反應是________反應(填“吸熱”或“放熱”)
(2)當反應達到平衡時,升高溫度,A的轉化率________(填“增大”“減小”或“不變”)。原因是________________________________________。
(3)反應體系中加入催化劑,對反應熱是否有影響?________;原因是_________________________________________________。
(4)反應體系中加入催化劑,反應速率________(填“增大”“減小”或“不變”);反應的活化能________(填“增大”“減小”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com