
【題目】CO是大氣污染氣體,可利用化學反應進行治理或轉化。
(1)甲醇是重要的溶劑和燃料,工業上用CO和H2在一定條件下制備CH3OH的反應為:CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①T℃時,向容積為2L的恒容密閉容器中充入1 mol CO和1.2 mol H2,一段時間后達到平衡,此時H2與CH3OH的體積分數之比為2:5,該反應的平衡常數K=___________;此時若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),則平衡將___________移動。(填“向正反應方向”“不”或“向逆反應方向”)
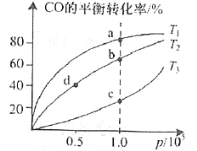
②在一容積可變的密閉容器中充入一定物質的量的CO和H2,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。a、b、c三點平衡常數K(a)、K(b)、K(c)的大小關系是___________。b、d點的正反應速率vb(CO)_______va(CO).
(2)瀝青混凝土可作為2CO(g)+O2(g)![]() 2CO2(g)反應的催化劑。圖表示在相同的恒容密閉容器、相同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
2CO2(g)反應的催化劑。圖表示在相同的恒容密閉容器、相同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
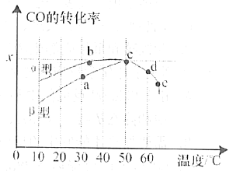
①a、b、c、d四點中表示平衡狀態的是___________;
②e點轉化率出現突變的原因可能是______________________。
(3)電解法轉化CO2可實現CO2資源化利用。電解時CO2在陰極區轉化為HCOOH,其原理示意圖如下:
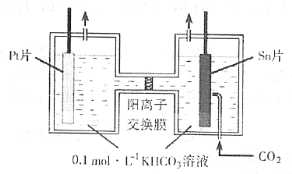
電解一段時間后,陽極區的KHCO3溶液濃度降低,其原因是_________________________。
【答案】100 正反應方向 K(a) > K(b) > K(c) > c、d 溫度升高后催化劑失去活性 陽極產生O2,pH降低,HCO3-的濃度降低,K+部分遷移至陰極區
【解析】
(1)①同一容器中,兩種氣體的體積之比等于物質的量之比,計算出平衡時反應物生成物各自的物質的量濃度,然后計算平衡常數,達到平衡后再通入0.4 mol CO和0.2 mol CH3OH(g),計算此時的濃度商,然后與平衡常數對比;
②CO(g)+2H2(g)![]() CH3OH(g) △H<0,該反應正反應為放熱反應,當壓強相同時,溫度越高CO的平衡轉化率越低,結合圖象,T1<T2<T3,對應放熱反應,溫度越高,平衡常數越小;同溫時壓強越大反應速率越快;
CH3OH(g) △H<0,該反應正反應為放熱反應,當壓強相同時,溫度越高CO的平衡轉化率越低,結合圖象,T1<T2<T3,對應放熱反應,溫度越高,平衡常數越小;同溫時壓強越大反應速率越快;
(2)①對應放熱反應,當反應達到平衡后,升高溫度平衡要逆向移動,反應物轉化率下降,判斷a、b、c、d四點中哪個點處于平衡狀態;
②e點轉化率出現突變的原因可能是溫度升高催化劑中毒,失去活性;
(3)陽極產生發生的電極反應式為:2H2O-4e-=O2↑+4H+,陽極產生的H+與HCO3-反應,導致HCO3-的濃度降低,K+部分遷移至陰極區。
(1)①CO(g)+2H2(g)![]() CH3OH(g),T℃時,向容積為2L的恒容密閉容器中充入1 mol CO和1.2 mol H2,一段時間后達到平衡,令反應消耗CO的物質的量為xmol,反應中反應物、生成物物質的量變化之比等于化學計量數之比,故反應消耗H2的物質的量為2xmol,反應生成CH3OH的物質的量為xmol,故平衡時n(CO)=(1-x)mol,n(H2)=(1.2-2x)mol,n(CH3OH)=xmol,同一容器中,兩氣體的體積之比等于物質的量之比,(1.2-2x):x=2:5,x=5/6,x=0.5,故平衡時n(CO)=0.5mol,n(H2)=0.2mol,n(CH3OH)=0.5mol,c(CO)=0.25 mol·L-1,c(H2)=0.1mol·L-1,c(CH3OH)= 0.25 mol·L-1,K=0.25/[0.25×(0.1)2]=100;此時向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),容器中CO、CH3OH的物質的量濃度變為0.45 mol·L-1、0.35 mol·L-1,Qc=0.35/[0.45×(0.1)2]=77.7<100,說明此時平衡向正反應方向移動;
CH3OH(g),T℃時,向容積為2L的恒容密閉容器中充入1 mol CO和1.2 mol H2,一段時間后達到平衡,令反應消耗CO的物質的量為xmol,反應中反應物、生成物物質的量變化之比等于化學計量數之比,故反應消耗H2的物質的量為2xmol,反應生成CH3OH的物質的量為xmol,故平衡時n(CO)=(1-x)mol,n(H2)=(1.2-2x)mol,n(CH3OH)=xmol,同一容器中,兩氣體的體積之比等于物質的量之比,(1.2-2x):x=2:5,x=5/6,x=0.5,故平衡時n(CO)=0.5mol,n(H2)=0.2mol,n(CH3OH)=0.5mol,c(CO)=0.25 mol·L-1,c(H2)=0.1mol·L-1,c(CH3OH)= 0.25 mol·L-1,K=0.25/[0.25×(0.1)2]=100;此時向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),容器中CO、CH3OH的物質的量濃度變為0.45 mol·L-1、0.35 mol·L-1,Qc=0.35/[0.45×(0.1)2]=77.7<100,說明此時平衡向正反應方向移動;
②CO(g)+2H2(g)![]() CH3OH(g) △H<0,該反應正反應為放熱反應,當壓強相同時,溫度越高CO的平衡轉化率越低,結合圖象,T1<T2<T3,正反應為放熱反應,溫度越高,正反應的平衡常數越小,故K(a) > K(b) > K(c);在其他條件相同時,增大壓強,化學反應速率加快,由于壓強b> d,vb(CO) > va(CO).;
CH3OH(g) △H<0,該反應正反應為放熱反應,當壓強相同時,溫度越高CO的平衡轉化率越低,結合圖象,T1<T2<T3,正反應為放熱反應,溫度越高,正反應的平衡常數越小,故K(a) > K(b) > K(c);在其他條件相同時,增大壓強,化學反應速率加快,由于壓強b> d,vb(CO) > va(CO).;
(2)①當反應達到平衡后,升高溫度平衡要逆向移動,CO的轉化率降低,則a、b、c、d四點中表示平衡狀態的是c、d;
②e點轉化率出現突變的原因可能是溫度升高后催化劑失去活性;
(3)陽極產生發生的電極反應式為:2H2O-4e-=O2↑+4H+,陽極產生的H+與HCO3-反應,H++ HCO3-= CO2↑+H2O,HCO3-的濃度降低,K+部分遷移至陰極區。


科目:高中化學 來源: 題型:
【題目】CO2是自然界碳循環中的重要物質。下列過程會引起大氣中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃燒 D. 碳酸鹽的沉積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化錳不僅是活性好的催化劑,也被廣泛用作干電池的正極材料。某化學小組設計用高硫錳礦(主要成分為錳的化合物和硫化亞鐵)為原料制取二氧化錳的工藝流程如圖:
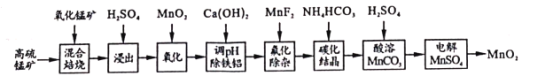
已知:①“混合焙燒”后的燒渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在該條件下,金屬離子開始沉淀和完全沉淀的pH如表:
金屬離子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
開始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)寫出浸出時與鋁元素有關的離子反應方程式____。
(2)上述“氧化”步驟是否可省略____(填“是”或“否”),你的依據是 _____。
(3)“調pH除鐵鋁’’時,生成沉淀的pH范圍為____;“氟化除雜”中除去的離子為____。
(4)請用平衡移動原理解釋除雜處理后的Mn2+用NH4HCO3轉化成MnCO3沉淀的過程___(用文字和離子方程式表達)。
(5)用惰性電極電解MnSO4制備MnO2時,其陽極反應式為____;整個流程中能夠循環利用的物質除MnO2外還有___(寫名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 減小
減小
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的飽和溶液中加入少量AgNO3,溶液中![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在體積均為20mL、濃度均為0.1mol·L-1的HX溶液、HY溶液中分別滴加同濃度的NaOH溶液,反應后溶液中水電離的c(H+)表示為pH水=-lgc(H+)水。pH水與滴加氫氧化鈉溶液體積的關系如圖所示。
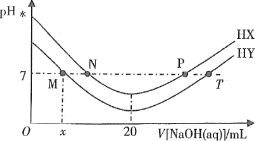
下列推斷正確的是
A.HX的電離方程式為HX=H++X-
B.T點時c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常溫下用蒸餾水分別稀釋N、P點溶液,pH都降低
D.常溫下,HY的電離常數![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲線如圖所示。下列說法正確的是

A. 點①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B. 點②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C. 點③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 在整個滴定過程中:溶液中![]() 始終不變
始終不變
查看答案和解析>>
科目:高中化學 來源: 題型:
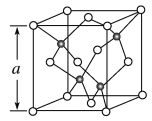
【題目】(1)Cu的一種氯化物晶胞結構如圖所示(黑球表示銅原子,白球表示氯原子),該氯化物的化學式是__。若該晶體的密度為ρg·cm-3,以NA表示阿伏加德羅常數的值,則該晶胞的邊長a=__nm。
(2)一種四方結構的超導化合物的晶胞如圖1所示,晶胞中Sm和As原子的投影位置如圖2所示。
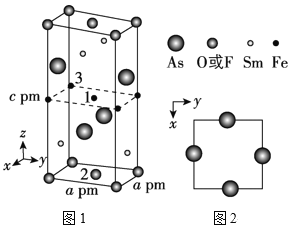
圖中F-和O2-共同占據晶胞的上下底面位置,若兩者的比例依次用x和1x代表,則該化合物的化學式表示為__,通過測定密度ρ和晶胞參數,可以計算該物質的x值,完成它們關系表達式:ρ=__g·cm-3。
以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標,例如圖1中原子1的坐標為(![]() ,
,![]() ,
,![]() ),則原子2和3的坐標分別為__、__。
),則原子2和3的坐標分別為__、__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容器中發生一個化學反應,反應過程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六種離子。在反應過程中測得ClO-和N2的物質的量隨時間變化的曲線如圖所示。下列有關判斷中不正確的是

A.還原劑是含CN-的物質,氧化產物不只有N2
B.氧化劑是ClO-,還原產物是HCO3-
C.參與反應的氧化劑與還原劑的物質的量之比為2:5
D.標準狀況下若生成2.24LN2則轉移電子為1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列反應可用于檢測司機是否酒后駕駛:![]()
![]() 。
。
①配合物![]() 中,與
中,與![]() 形成配位鍵的原子是__________(填元素符號)。
形成配位鍵的原子是__________(填元素符號)。
②![]() 中
中![]() 原子的雜化軌道類型是________;
原子的雜化軌道類型是________;![]()
![]() 含有
含有![]() 鍵的數目為_______。
鍵的數目為_______。
(2)![]() 分子中,
分子中,![]() 原子的雜化軌道類型是__________;寫出由3個原子組成且與
原子的雜化軌道類型是__________;寫出由3個原子組成且與![]() 具有相同空間構型的離子:___________(填一個即可)。
具有相同空間構型的離子:___________(填一個即可)。
(3)石墨烯(結構如圖1所示)是一種由單層碳原子構成的具有平面結構的新型碳材料,石墨烯中部分碳原子被氧化后,其平面結構會發生改變,轉化為氧化石墨烯(結構如圖2所示)。

氧化石墨烯中2號![]() 原子的雜化方式是_________,該
原子的雜化方式是_________,該![]() 原子與相鄰
原子與相鄰![]() 原子形成的鍵角______(填“>”“<”或“=”)石墨烯中1號
原子形成的鍵角______(填“>”“<”或“=”)石墨烯中1號![]() 與相鄰
與相鄰![]() 形成的鍵角。
形成的鍵角。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com