
【題目】將40克NaOH溶于水中,配制成1L溶液,則該溶液的物質的量濃度為( )
A. 0.1mol/L B. 0.5mol/L C. 4mol/L D. 1mol/L
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】描述下列反應的現象并寫出反應的離子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,現象:__________________,離子方程式:____________________
(2)向NaHCO3溶液中滴加稀H2SO4,現象:__________________,離子方程式:__________________
(3)稀HNO3和Ba(OH)2溶液混合,現象:__________________,離子方程式:____________________
(4)比較:上述三個離子反應發生的條件的不同點是______________________;相同點是________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CO2+Ca(OH)2![]() CaCO3↓+H2O,CaCO3+CO2+H2O
CaCO3↓+H2O,CaCO3+CO2+H2O![]() Ca(HCO3)2,且Ca(HCO3)2易溶于水。試根據如圖所示裝置回答下列問題:
Ca(HCO3)2,且Ca(HCO3)2易溶于水。試根據如圖所示裝置回答下列問題:
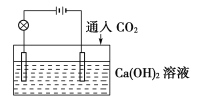
(1)通入CO2前,燈泡________(填“亮”或“不亮”)。
(2)開始通入CO2時,燈泡的亮度________。
(3)繼續通入過量的CO2,燈泡的亮度________。
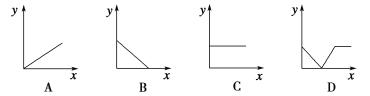
(4)下列四個圖中,_______(填字母)能比較準確地反映出溶液的導電能力和通入CO2氣體量的關系(x軸表示CO2通入的量,y軸表示導電能力)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】尿黑酸是由酪氨酸在人體內非正常代謝而產生的一種物質.其轉化過程如下: 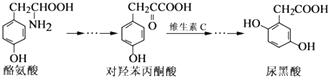
下列說法錯誤的是( )
A.酪氨酸既能與鹽酸反應,又能與氫氧化鈉反應
B.1 mol尿黑酸與足量濃溴水反應,最多消耗3 mol Br2
C.對羥基苯丙酮酸分子中在同一平面上的碳原子至少有7個
D.1 mol尿黑酸與足量NaHCO3反應,最多消耗3 mol NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中錯誤的是( )
A.離子晶體在熔化狀態下能導電
B.在晶體中只要有陰離子就一定有陽離子
C.原子晶體中一定有非極性共價鍵
D.分子晶體中不一定含有共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】脫水環化是合成生物堿類天然產物的重要步驟,某生物堿V合成路線如下: 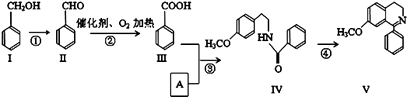
(1)Ⅱ中含氧官能團的名稱 .
(2)反應②的化學方程式 .
(3)下列說法正確的是 .
A.Ⅰ和Ⅴ均屬于芳香烴
B.Ⅱ能發生銀鏡反應
C.Ⅱ能與4molH2發生加成反應
D.反應③屬于酯化反應
(4)A的結構簡式 .
(5)Ⅵ與Ⅰ互為同分異構體,Ⅵ遇FeCl3發生顯色反應,其苯環上的一氯代物只有2種.寫出滿足上述條件的Ⅵ的結構簡式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】濃鹽酸和Ca(ClO)2能發生反應: Ca(ClO)2+4HCl=CaCl2+2H2O+Cl2↑,用久置漂白粉和濃鹽酸反應得到的氯氣中,可能含有的雜質氣體是①CO2,②HCl,③H2O,④O2
A. ①②③B. ②③④C. ②③D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作均要用玻璃棒,其中玻璃棒作用相同的是( )
①過濾 ②蒸發 ③向容量瓶轉移液體
A. ①和③ B. ①和② C. ②和③ D. ①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一個完整的氧化還原反應方程式可以拆開,寫成兩個“半反應式”,一個是“氧化反應式”,一個是“還原反應式”。如Fe+Cu2+=Fe2++Cu,可拆寫為氧化反應式:Fe-2e-=Fe2+,還原反應式:Cu2++2e-=Cu。據此,回答下列問題:
(1)將反應Zn+2H+=Zn2++H2↑拆寫為兩個“半反應式”:
氧化反應式:_______________________,還原反應式:_______________________。
(2)將反應2Fe3++Cu=2Fe2++Cu2+拆寫為兩個“半反應式”:
氧化反應式:_______________________,還原反應式:_______________________。
(3)已知某反應的兩個“半反應式”為:氧化反應式CH4+10OH--8e-=![]() +7H2O,還原反應式O2+2H2O+4e-=4OH-,則氧化還原反應方程式為___________________。
+7H2O,還原反應式O2+2H2O+4e-=4OH-,則氧化還原反應方程式為___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com