
【題目】氯堿廠電解飽和食鹽水制取的工藝流程圖如下:
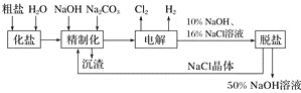
(1)在電解過程中,與電源正極相連的電極上所發生反應的電極反應式為______________,與電源負極相連的電極上所發生反應的電極反應式為__________________。
(2)工業食鹽含Ca2+、Mg2+等雜質,精制過程中發生反應的離子方程式為________________________________________________________________________。
(3)如果粗鹽中![]() 含量較高,必須添加鋇試劑除去
含量較高,必須添加鋇試劑除去![]() ,該鋇試劑可以是______(填字母)。
,該鋇試劑可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)為有效除去Ca2+、Mg2+、![]() ,加入試劑的合理順序為________。
,加入試劑的合理順序為________。
a、先加NaOH,后加Na2CO3,再加鋇試劑
b、先加NaOH,后加鋇試劑,再加Na2CO3
c、先加鋇試劑,后加NaOH,再加Na2CO3
(5)脫鹽工序中利用NaOH和NaCl在溶解度上的差異,通過________、冷卻、結晶、________(填寫操作名稱)除去NaCl。
【答案】2Cl--2e-=Cl2↑ 2H++2e-=H2↑ Ca2++![]() =CaCO3↓、Mg2++2OH-=Mg(OH)2↓ ac bc 蒸發 過濾
=CaCO3↓、Mg2++2OH-=Mg(OH)2↓ ac bc 蒸發 過濾
【解析】
(1)電解飽和食鹽水中,與電源正極相連的是陽極,陽極發生氧化反應;與電源負極相連的是陰極,發生還原反應;
(2)碳酸鈉與鈣離子反應生成碳酸鈣沉淀,氫氧化鈉與鎂離子反應生成氫氧化鎂沉淀;
(3)硫酸根離子可用鋇離子除去,但不能選擇硝酸鋇,因為會引入NO3-;
(4)鈣離子用碳酸鈉除去,過量的碳酸根離子用鹽酸除去,且硫酸根所用的鋇試劑是過量的,而過量的鋇離子也用碳酸鈉除去,所以只要最后加入碳酸鈉即可;
(5)根據氫氧化鈉與氯化鈉溶解度的不同,將溶液蒸發,冷卻,析出的氯化鈉過濾除去。
(1)電解飽和食鹽水中,與電源正極相連的電極為電解池的是陽極,陽極發生氧化反應,所以是氯離子失去電子生成氯氣,電極反應式為2Cl--2e-=Cl2↑;與電源負極相連的電極為電解池的陰極,陰極發生還原反應,所以水電離產生的氫離子得到電子生成氫氣,電極反應式為2H++2e-=H2↑,故答案為2Cl--2e-=Cl2↑,2H++2e-=H2↑。
(2)工業鹽中的鈣、鎂離子用碳酸鈉、氫氧化鈉溶液除去,碳酸鈉與鈣離子反應生成碳酸鈣沉淀,氫氧化鈉與鎂離子反應生成氫氧化鎂沉淀,離子方程式為Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,故答案為:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓。
(3)硫酸根離子用鋇試劑除去,可選擇氫氧化鋇或氯化鋇溶液,不能選擇硝酸鋇溶液,因為過量的鋇離子可用碳酸鈉除去,碳酸根離子、氫氧根離子再用鹽酸除去,而硝酸鋇中的硝酸根離子無法除去,造成食鹽不純;故答案為:ac。
(4)有效除去Ca2+、Mg2+、SO42-,應注意碳酸鈉在鋇試劑之后,是為除去過量的鋇離子,所以可先加NaOH,后加鋇試劑,再加Na2CO3,也可以先加鋇試劑,后加Na2CO3,再加NaOH,所以bc正確,故答案為:bc。
(5)脫鹽工序的目的是分離NaOH和NaCl,由于NaCl溶解度小,因而NaCl首先析出,其操作過程是蒸發、冷卻、結晶、過濾得到NaCl晶體,故答案為:蒸發,過濾。


科目:高中化學 來源: 題型:
【題目】有MgCl2和Al2(SO4)3的混合溶液,向其中不斷加入NaOH溶液,得到的沉淀量與加入的NaOH溶液的體積關系如圖所示,則原溶液中MgCl2和Al2(SO4)3的物質的量濃度之比為( )

A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X為一種常見酸的濃溶液,能使蔗糖粉末變黑。A與X反應的轉化關系如下圖所示,其中反應條件及部分產物均已略去,則下列有關說法正確的是( )
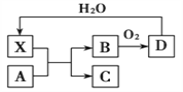
A. X使蔗糖變黑的現象主要體現了X的強氧化性
B. 若A為鐵,則足量A與X在室溫下即可完全反應
C. 若A為碳單質,則將C通入少量的澄清石灰水,一定可以觀察到白色沉淀產生
D. 工業上,B轉化為D的反應條件為高溫、常壓、使用催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室中現用Fe與鹽酸反應制取22.4L H2(標準狀況下)。
(1)消耗Fe的物質的量為________
(2)如果選用所貼標簽為2.0molL-1的鹽酸,至少需該鹽酸________升?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C是與生命活動密切相關的三種常見化合物,每種物質所含元素種類均不超過三種,甲是單質。它們之間有如下轉化關系:
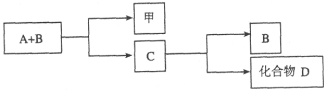
化合物D也是生活中常見的化合物,在一定條件下可發生如下反應:D+3甲![]() 3A+2B
3A+2B
請回答下列問題:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常溫下,A和B通過__________轉化為C。該過程的能量轉化關系如何?
____________________。
(3)寫出由C生成D的反應的化學方程式____________________。
(4)化合物C是人類生命活動不可缺少的物質之一,它在血液中的正常含量是__________。
(5)目前化合物B在大氣中含量呈上升趨勢,對環境造成的影響是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用元素的化合價推測物質的性質是化學研究的重要手段。如圖是硫元素的常見化合價與部分物質類別的對應關系:
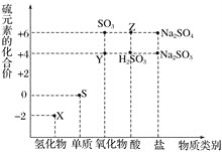
(1)從硫元素化合價變化的角度分析,圖中既有氧化性又有還原性的化合物有_______________(填化學式)。
(2)將X與Y混合,可生成淡黃色固體。該反應中氧化劑與還原劑的物質的量之比為_____________。
(3)檢驗物質Y的方法是______________________________。
(4)Z的濃溶液與銅單質在一定條件下可以發生化學反應,該反應的化學方程式為____________。
(5)Na2S2O3是重要的化工原料,從氧化還原反應的角度分析,下列制備Na2S2O3的方案理論上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化為Na2SO4,則24mL 0.05mol·L-1的Na2SO3溶液與 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反應時,Cr元素在還原產物中的化合價為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵、移動支付、共享單車、網購,被稱為中國“新四大發明”。用于高鐵和共享單車制造業的重要金屬材料是( )

A.Na﹣K合金B.Cu﹣Sn合金C.Sn﹣Pb合金D.Mg﹣Al合金
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在VL Al2(SO4)3溶液中,含Al3+的質量為a g,則Al2(SO4)3溶液的物質的量濃度為__
(2)有以下物質:①AgCl;②CCl4;③醫用酒精;④液氧;⑤二氧化碳;⑥碳酸氫鈉固體;⑦氫氧化鋇溶液;⑧食醋;⑨氧化鈉固體;⑩氯化氫氣體。其中屬于電解質的是_____(填序號,下同);屬于非電解質的是_____
(3)實驗室簡單模擬從海水中提取溴單質的部分流程如圖
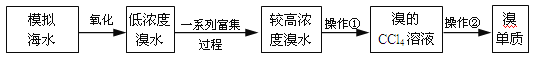
實驗操作②的名稱_____,操作①中要用到的玻璃儀器_____、_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表是A、B、C、D四種有機物的有關信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型為 ③能與水在一定條件下反應生成有機物C |
B | ①由C、H兩種元素組成;②球棍模型為 |
C | ①由C、H、O三種元素組成;②能與Na反應,但不能與NaOH溶液反應;③在Cu作催化劑且加熱條件下能與O2反應 |
D | ①由C、H、O三種元素組成;②球棍模型為 ③能與C反應生成相對分子質量為100的酯 |
回答下列問題:
(1)A與溴的四氯化碳溶液反應的生成物的名稱是___。
(2)B具有的性質是____(填序號)。
①無色無味液體 ②有毒 ③不溶于水 ④密度比水大 ⑤與酸性KMnO4溶液和溴水反應褪色 ⑥任何條件下不與氫氣反應 ⑦與溴水混合后液體分層且上層呈橙紅色。
(3)由B制備硝基苯的化學方程式____。
(4)D與C反應能生成相對分子質量為100的酯,該反應的反應類型為___;其化學方程式為____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com