
【題目】A + B → X + Y + H2O(未配平,反應條件略去)是中學常見反應的化學方程式,請回答:
(1)若Y為黃綠色氣體:
①當 A、B的物質的量之比為1∶4且A為黑色固體時,該反應的離子方程式是 ;
②當 A、B的物質的量之比為1∶6時,寫出該反應的化學方程式,并用雙線橋表示反應過程中的電子轉移____________________。
③實驗室處理尾氣Y時常用NaOH而不用NaHSO3溶液,其原因是(用離子反應方程式表示)____________。
(2)若A為單質,B為無色油狀黏稠液體,當 A、B的物質的量之比為1∶2時,則A可能為______________,檢查其中刺激性氣體產物X的方法是_______________。
(3)常溫下A在B的濃溶液中會“鈍化”,且A可溶于X溶液中,若A為金屬單質,A和B以物質的量之比1∶4反應。
①過量的A和100mL2mol/L的B溶液充分反應后將溶液稀釋至500mL后溶液中陰離子的物質的量濃度為__________。
②含 a mol X的溶液溶解了一定量A后,若溶液中兩種金屬陽離子的物質的量之比為1∶2時,則被還原的X是 mol。
(4)若A、B、X、Y均為化合物。向A溶液中加入硝酸酸化的AgNO3溶液,產生白色沉淀;B的焰色為黃色。則A與B按物質的量之比1:4反應后,溶液中溶質的化學式為 。
(5)若A、B、X、Y均為化合物。X為極易溶于水的氣體,則鹽A是_______鹽,生成氣體X的離子方程式為 ,檢驗該氣體的方法是 。
【答案】(1)①MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
②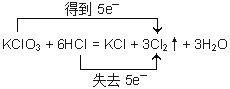
③4HSO3—+Cl2=SO42—+2Cl—+3SO2↑+2H2O
(2)①C、Cu;②將氣體X通入品紅溶液中,若品紅溶液褪色,證明氣體X是SO2
(3)①0.3mol/L(1分);②![]() a或
a或![]() a(4)NaAlO2 NaCl
a(4)NaAlO2 NaCl
(5)銨,NH4++OH﹣![]() NH3↑+H2O;將濕潤的紅色石蕊試紙粘在玻璃棒上,靠近集氣瓶口若試紙變藍,則說明該氣體為氨氣。
NH3↑+H2O;將濕潤的紅色石蕊試紙粘在玻璃棒上,靠近集氣瓶口若試紙變藍,則說明該氣體為氨氣。
【解析】
試題分析:(1)如果Y是黃綠色氣體,則Y是氯氣。①當 A、B的物質的量之比為1∶4且A為黑色固體,則該反應為二氧化錳與濃鹽酸混合加熱制備氯氣,反應離子方程式為MnO2 + 4H+ + 2Cl—![]() Mn2+ + Cl2↑ + 2H2O ;②當 A、B的物質的量之比為1∶6,則該反應為氯酸鉀與濃鹽酸反應生成氯氣、氯化鉀的水,化學方程式為KClO3+6HCl=KCl+3H2O+3Cl2↑。反應中氧化劑是氯酸鉀,還原劑是氯化氫,根據電子得失守恒可知氧化劑與還原劑的物質的量之比是1:5,即反應中轉移5個電子,所以用雙線橋表示反應過程中的電子轉移見答案;③氯氣具有強氧化性,而亞硫酸氫鈉具有還原性,二者發生氧化還原反應生成酸、鈉鹽與水。反應中產生的酸能與亞硫酸氫鈉反應產生二氧化硫,SO2是大氣污染物,因此一般不用亞硫酸氫鈉,而用氫氧化鈉,反應的離子方程式為4HSO3— + Cl2==SO42— + 2Cl— + 3SO2↑ + 2H2O 。
Mn2+ + Cl2↑ + 2H2O ;②當 A、B的物質的量之比為1∶6,則該反應為氯酸鉀與濃鹽酸反應生成氯氣、氯化鉀的水,化學方程式為KClO3+6HCl=KCl+3H2O+3Cl2↑。反應中氧化劑是氯酸鉀,還原劑是氯化氫,根據電子得失守恒可知氧化劑與還原劑的物質的量之比是1:5,即反應中轉移5個電子,所以用雙線橋表示反應過程中的電子轉移見答案;③氯氣具有強氧化性,而亞硫酸氫鈉具有還原性,二者發生氧化還原反應生成酸、鈉鹽與水。反應中產生的酸能與亞硫酸氫鈉反應產生二氧化硫,SO2是大氣污染物,因此一般不用亞硫酸氫鈉,而用氫氧化鈉,反應的離子方程式為4HSO3— + Cl2==SO42— + 2Cl— + 3SO2↑ + 2H2O 。
(2)若A為單質,B為無色油狀黏稠液體,當 A、B的物質的量之比為1:2時,該反應為碳與濃硫酸反應生成CO2、二氧化硫與水,或銅與濃硫酸反應生成硫酸銅、二氧化硫與水,則A為C和Cu,刺激性氣體產物X為二氧化硫,SO2具有漂白性,能使品紅溶液褪色,因此檢驗二氧化硫的方法為將氣體X通入品紅溶液中,若品紅溶液褪色,證明氣體X是SO2。
(3)若A為金屬單質,常溫下A在B的濃溶液中“鈍化”,且A可溶于X溶液中,則A是鐵,而不是鋁,該反應為Fe與稀硝酸反應生成硝酸鐵、NO與水。①100mL2mol/L的硝酸溶液中硝酸的物質的量為0.1L×2mol/L=0.2mol,過量的鐵與稀硝酸發生反應3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,生成硝酸亞鐵的物質的量為:0.2mol×3/8=0.075mol,其中硝酸根離子的物質的量是0.075mol×2=0.15mol,稀釋至500mL后溶液中陰離子的物質的量濃度為0.15mol÷0.5L=0.3mol/L;②鐵離子能氧化單質鐵生成亞鐵離子,設被還原的硝酸鐵的物質的量是xmol,則根據反應的方程式2Fe3++Fe===3Fe2+可知反應后溶液中Fe3+的物質的量為(a-x)mol,Fe2+的物質的量為1.5xmol,則(a-x):1.5x=1:2,解得x=4a/7;或(a-x):1.5x=2:1,解得x=a/4。
(4)若A、B、X、Y均為化合物.向A溶液中加入硝酸酸化的AgNO3溶液,產生白色沉淀,白色沉淀是氯化銀,則A中含有Cl-;B的焰色反應為黃色,應該含有Na元素。如果A和B按物質的量之比1:3反應產生白色沉淀,則A為氯化鋁、B為氫氧化鈉;如果A與B按物質的量之比1:4反應則恰好生成偏鋁酸鈉、氯化鈉和水,反應的化學方程式為AlCl3+4NaOH===NaAlO2+3NaCl+H2O,因此反應后溶液中溶質的化學式為NaAlO2、NaCl;
(5)若A、B、X、Y均為化合物.X為極易溶于水的氣體,X應該是氨氣,則A是銨鹽,B為強堿。檢驗該氣體的方法是將濕潤的紅色石蕊試紙粘在玻璃棒上,靠近集氣瓶口若試紙變藍,則說明該氣體為氨氣。


科目:高中化學 來源: 題型:
【題目】下列實驗操作中,符合操作規范的是
A.向試管中滴加試劑時,將滴管下端緊靠試管內壁
B.用托盤天平稱量藥品時,右盤放藥品,左盤放砝碼
C.用pH試紙檢驗溶液的酸堿性時,將試紙浸入溶液中
D.萃取操作中倒轉分液漏斗用力振蕩時,應關閉玻璃塞和活塞
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,杠桿AB兩端分別掛有體積相同、質量相等的空心銅球和空心鐵球,調節杠桿并使其在水中保持平衡,然后小心地向燒杯中央滴入濃CuSO4溶液,一段時間后,下列有關杠桿的偏向判斷正確的是(實驗過程中,不考慮鐵絲反應及兩球的浮力變化)( ) 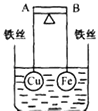
A.杠桿為導體和絕緣體時,均為A 端高B 端低
B.杠桿為導體和絕緣體時,均為A 端低B 端高
C.當杠桿為絕緣體時,A端低,B端高;為導體時,A端高,B端低
D.當杠桿為絕緣體時,A端高,B端低;為導體時,A端低,B端高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳原子數為2的烴所具有的共同性質是( )
A.都難溶于水,且密度比水小
B.都能使溴水褪色
C.分子中各原子都處在同一平面內
D.都能通過加聚反應生成高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的物質,一定互為同系物的是
A.C2H4 和C4H8B.CH4和C3H8C.C2H6O和C3H8OD.C2H4Br2和C3H6Cl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在2 L的密閉容器中發生反應:M(g)+2N(g)![]() xP(g) ΔH<0,N、P的物質的量隨時間變化的關系如圖所示。下列有關說法不正確的是( )
xP(g) ΔH<0,N、P的物質的量隨時間變化的關系如圖所示。下列有關說法不正確的是( )

A. x=2
B. 反應開始2 min內,v(P)=0.1 mol·L-1·min-1
C. 2 min后,降低溫度平衡向右移動
D. 當容器內混合氣體壓強不再改變時,反應體系達到化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】a mol Fe3O4與b mol FeO投入V L c mol·L-1的HNO3溶液(過量)中,充分反應,產生氣體為NO,則反應后溶液中NO3-的量為
A. 62(a+b) g B. 186(a+b) g
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.一定條件下,通過下列反應可實現燃煤煙氣中硫的回收:
SO2(g)+ 2CO(g)![]() 2CO2(g) + S(l) △H<0
2CO2(g) + S(l) △H<0
完成下列問題:
(1)該反應的平衡常數表達式是 ___________;2L容器中,10分鐘內,氣體密度減小了8g/L,則CO的反應速率是____________。
(2)如果要提高上述反應的反應速率,可以采取的措施是________。(選填編號)
a.減壓 b.增加SO2的濃度 c.升溫 d.及時移走產物
(3)若反應在恒容的密閉容器中進行,下列有關說法正確的是________。(選填編號)
A.平衡前,隨著反應的進行,容器內壓強始終不變
B.當容器內溫度不再變化時,反應達到了平衡
C.平衡時,其他條件不變,升高溫度可增大平衡常數
D.其他條件不變,使用不同催化劑,該反應熱效應不同
Ⅱ.硫酸工業尾氣SO2用NaOH溶液吸收后會生成Na2SO3。現有常溫下0.1mol/L Na2SO3溶液,實驗測定其pH約為8,完成下列問題:
(4)該溶液中c(Na+)與 c(OH-) 之比為___________。
該溶液中c(OH—) = c(H+)+ ______+ ________(用溶液中所含微粒的濃度表示)。
(5)用酸性重鉻酸鉀(K2Cr2O7)溶液也能吸收SO2,重鉻酸鉀被還原為Cr3+,寫出該反應的離子方程式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 制備溴苯時可以用苯和溴水反應
B. 乙醇既可以做燃料也可以在日常生活中使用,如無水乙醇常用于消毒
C. 等質量的乙烯和聚乙烯完全燃燒耗氧量相同
D. 分子組成上相差若干個CH2的有機物必定互為同系物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com