
【題目】下列說法中正確的是
①鋼鐵表面烤藍生成一層致密的Fe3O4,能起到防腐蝕作用;②砹(At)是第ⅦA族,其氫化物的穩定性大于HCl;③Na2FeO4可做水的消毒劑和凈化劑;④陶瓷、玻璃、水晶、瑪瑙、水泥、光導纖維的主要成分都是硅酸鹽;⑤鉈(Tl)與鋁同主族,其單質既能與鹽酸反應,又能與氫氧化鈉溶液反應;⑥第三周期金屬元素的最高價氧化物對應的水化物,其堿性隨原子序數的增大而減弱;⑦海水提鎂的主要步驟為:

A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
【答案】B
【解析】
①致密的氧化物能保護里面的金屬;②元素的非金屬性越強,氣態氫化物的穩定性越強;③Na2FeO4中鐵為+6價;④玻璃、水泥屬于硅酸鹽產品,水晶、石英、瑪瑙等主要成分都是SiO2;⑤根據元素周期表中同主族元素性質的變化規律來分析;⑥根據元素周期表中同周期元素性質的變化規律來比較金屬性,金屬性越強,則最高價氧化物對應水化物的堿性越強;⑦工業上是電解熔融的氯化鎂生產鎂;
①四氧化三鐵是致密的能保護內部的鋼鐵不被腐蝕,故①正確;
②第VIIA族Cl元素的非金屬性大于砹的非金屬性,則砹的氫化物的穩定性小于HCl,故②錯誤;
③Na2FeO4中鐵為+6價,具有強氧化性,能殺菌消毒,被還原后生成Fe3+,后水解為氫氧化鐵膠體能凈水,故③正確;
④玻璃、水泥屬于硅酸鹽產品,水晶、石英、瑪瑙等主要成分都是SiO2,故④錯誤;
⑤鉈(Tl)與鋁同主族,隨原子序數的增大,金屬性增強,則金屬性Tl>Al,則Tl能與酸反應,但不與氫氧化鈉溶液反應,故⑤錯誤;
⑥第三周期金屬元素隨原子序數的增大金屬性減弱,金屬性Na>Mg>Al,則金屬元素的最高價氧化物對應水化物,其堿性隨原子序數的增大而減弱,故⑥正確;
⑦電解氯化鎂溶液得不到Mg,工業上是電解熔融的氯化鎂生產鎂,故⑦錯誤;
故①③⑥正確,答案選B。


科目:高中化學 來源: 題型:
【題目】已知298K時,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物質的量濃度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液產生兩種沉淀,溶液中陽離子、陰離子濃度關系如圖所示。下列說法錯誤的是

A. 常溫下NiCO3的溶解度大于NiS的溶解度
B. 向d點對應的溶液中加入對應陰離子的鈉鹽,d點向b點移動
C. 對于曲線I,在b點加熱,b點向c點移動
D. P為3.5且對應的陰離子是CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置可用來制取和觀察Fe(OH)2在空氣中被氧化的須色變化。實驗時必須使用鐵屑和6mol/L的硫酸,其他試劑任選。完成下列問題:
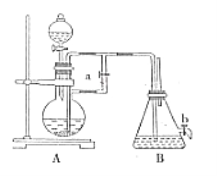
(1)B中盛有一定量的NaOH溶液,A中應預先加入的試劑是_______________,A中發生反應的目的是_____________________________。
(2)實驗開始時應先將彈簧夾a________(填“打開”或“關閉”)。
(3)裝置B中生成Fe(OH)2的操作及觀察到的現象為_______________。
(4)實驗完畢,打開b處彈簧夾,放入一部分空氣,此時B中發生的反應為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于Na2CO3和NaHCO3的說法中,不正確的是
A. 焰色反應均為黃色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加熱的方法除去Na2CO3固體中的NaHCO3雜質
D. 物質的量相同的兩種固體分別與足量鹽酸反應,Na2CO3產生的二氧化碳多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH4Al(SO4)2、NH4HSO4用途廣泛。請回答下列問題:
(1)常溫時,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。則溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填數值)。
(2)80℃時,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析導致pH隨溫度變化的原因是________________________ (用離子方程式并結合文字敘述回答)。
(3)常溫時,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH與NaOH溶液體積的關系曲線如圖所示。向NH4HSO4溶液中滴加NaOH溶液到a點的過程中,發生反應的離子方程式為__________________。
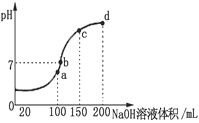
(4)濃度均為0.1 mol·L-1 NH4Al(SO4)2溶液和NH4HSO4溶液,其中______溶液c(NH4+)大。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:常溫下,Ksp(AgNO2)=2×10-8 mol2·L-2;Ksp(AgCl)=1.8×10-10 mol2·L-2。
(1)向2 mL 0.1 mol·L-1 NaNO2 溶液中滴加幾滴稀硝酸銀溶液,出現白色沉淀,再滴入0.5 mol·L-1 NaCl溶液,發生反應:AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq),則該反應的化學平衡常數K= 。
AgCl(s)+NO2-(aq),則該反應的化學平衡常數K= 。
(2)取物質的量濃度均為 0.1 mol·L-1 NaNO2、NaCl的混合溶液,逐滴加入AgNO3溶液(忽略體積改變)。當 AgNO2開始沉淀時,計算溶液中Cl-的物質的量濃度(寫出必要的計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反應中,下列說法不正確的是 ( )
KClO3+5KCl+3H2O的反應中,下列說法不正確的是 ( )
A. Cl2是氧化劑,KOH是還原劑
B. KCl是還原產物,KClO3是氧化產物
C. 反應中每消耗3 mol Cl2,轉移電子數為5NA
D. 被還原的氯氣的物質的量是被氧化的氯氣的物質的量的5倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池可以使用在航天飛機上,其反應原理如圖所示。下列有關氫氧燃料電池的說法中不正確的是
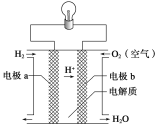
A. 該電池中電極a是正極
B. 外電路中電子由電極b通過導線流向電極a
C. 該電池的正極反應為O2+4H++4e- = 2H2O
D. 該電池的總反應:2H2+O2 = 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反應物為N2和H2物質的量之比為1:3,且總物質的量不變,在不同壓強和濫度下,反應達到平衡時體系中NH3的物質的量分數如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反應物為N2和H2物質的量之比為1:3,且總物質的量不變,在不同壓強和濫度下,反應達到平衡時體系中NH3的物質的量分數如下表:
溫度 物質的量分數 壓強 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列說法正確的是
A. 體系中NH3的物質的量分數越大,則正反應速率越大
B. 反應達到平衡時,N2和H2的轉化率之比均為1
C. 反應達到平衡時,放出的熱量均為92.4kJ
D. 600℃,30MPa下反應達到平衡時,生成NH3的物質的量最多
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com