
【題目】綠礬的化學式可表示為FeSO4·xH2O,在工農業生產中具有重要的用途。某化學興趣小組對綠礬的某些性質進行探究。回答下列問題:
(1)在試管中加入少量綠礬樣品,加水溶解,滴加少量稀H2SO4后,再滴加KSCN溶液,溶液顏色無明顯變化。充分振蕩后,溶液逐漸變紅。溶液變紅的原因是_________(用離子方程式表示)。
(2)為測定綠礬中結晶水含量,將石英玻璃管(帶兩端開關K1和K2)(設為裝置A)稱重,記為m1 g。將樣品裝入石英玻璃管中,再次將裝置A稱重,記為m2g。按下圖連接好裝置進行實驗。

①下列實驗操作步驟的正確排序為___________________(填標號);重復上述操作步驟,直至A恒重,記為m3g。
a.關閉K1和K2 b.打開K1和K2,緩緩通入N2 c.點燃酒精燈,加熱 d.稱量A e.冷卻到室溫 f.熄滅酒精燈
②判斷A是否恒重的方法是____________________。
③根據實驗記錄,綠礬化學式中結晶水數目x=________________(列式表示)。
(3)為探究硫酸亞鐵的分解產物,將(2)中已恒重的裝置A接入由下圖所示儀器組裝而成的裝置中,打開K1和K2,緩緩通入N2一段時間后,加熱。實驗后反應管中殘留固體為紅色粉末。
①反應中有兩種氣體產物生成,為檢驗該氣體混合物的組成,請從下圖所示的儀器中,選擇合適的儀器(含其中的試劑),組成一套實驗裝置,該裝置的連接順序(按氣體流向從左到右)依次為___________→D(填裝置序號)。裝置中除有氣泡冒出外,其他證明實驗結論的現象分別為__________________________。

②硫酸亞鐵高溫分解的化學方程式為_____________________。
【答案】 4Fe2+ + O2 + 4H+=4Fe3+ + 2H2O bcfead 最后兩次稱量 A的質量差不超過0.1克 ![]() C、B 生成白色沉淀、褪色 2FeSO4
C、B 生成白色沉淀、褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】(1)在試管中加入少量綠礬樣品,加水溶解,滴加少量稀H2SO4后,再滴加KSCN溶液,溶液顏色無明顯變化。可知樣品中沒有Fe(Ⅲ),但亞鐵離子不穩定,易被空氣中氧氣氧化生成鐵離子,最終溶液變紅色,反應的離子方程式為4Fe2+ + O2 + 4H+=4Fe3+ + 2H2O,故答案為:4Fe2+ + O2 + 4H+=4Fe3+ + 2H2O;
(2)①實驗時,為避免亞鐵被氧化,應先通入氮氣,冷卻時注意防止氧氣進入,冷卻至室溫再稱量固體質量的變化,則正確的順序為bcfead,故答案為:bcfead;
②最后兩次稱量 A的質量差不超過0.1克,可以判斷A已經恒重,故答案為:最后兩次稱量 A的質量差不超過0.1克;
③直至A恒重,記為m3g,應為FeSO4和裝置的質量,則m(FeSO4)=(m3-m1),m(H2O)=(m2-m3),則n(H2O)=![]() 、n(FeSO4)=
、n(FeSO4)=![]() ,結晶水的數目等于
,結晶水的數目等于![]() =
=![]() ,故答案為:
,故答案為: ![]() ;
;
(3)①實驗后反應管中殘留固體為紅色粉末,說明生成Fe2O3,則反應中Fe元素化合價升高,S元素化合價應降低,則一定生成SO2,可知硫酸亞鐵高溫分解可生成Fe2O3、SO3、SO2,C為氯化鋇,用于檢驗SO3,可觀察到產生白色沉淀,B為品紅,可用于檢驗SO2,品紅褪色,故答案為:C;B;產生白色沉淀、褪色;
②硫酸亞鐵高溫分解可生成Fe2O3、SO3、SO2,方程式為2FeSO4![]() Fe2O3+SO2↑+SO3↑,故答案為:2FeSO4
Fe2O3+SO2↑+SO3↑,故答案為:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】已知:lg C(s)燃燒生成一氧化碳放出9.2kJ的熱量;氧化亞銅與氧氣反應的能量變化如圖所示。下列敘述正確的是

A. 碳[C(s)]的燃燒熱△H為-110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O放出73kJ的熱量
C. 反應2Cu2O(s)+O2(g)=4CuO(s)的△H為292 kJ·mol-1
D. 足量炭粉與CuO反應生成Cu2O的熱化學方程式為:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H=35.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以鉛蓄電池為電源,石墨為電極電解CuSO4溶液,裝置如下圖。若一段時間后Y電極上有6.4 g紅色物質析出,停止電解。下列說法正確的是

A. a為鉛蓄電池的負極
B. 電解過程中,鉛蓄電池的負極增重30.3g
C. 電解結束時,左側溶液質量增重8g
D. 鉛蓄電池工作時正極電極反應式為:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛及其化合物廣泛用于蓄電池、機械制造、電纜護防等行業。
(1)鉛是碳的同族元素,比碳多4個電子層。鉛在元素周期表的位置為_________;
(2)鉛蓄電池是一種用途廣泛的二次電池。鉛蓄電池的電池反應通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
鉛蓄電池充電時,二氧化鉛電極應與外接電源的_________________(填“正極”或“負極”)相連接,該電極的電極反應式為________________________________。
(3)利用電解法可制得金屬鉛。將PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的電解液。用惰性電極電解Na2PbCl4溶液制得金屬Pb,裝置如下圖所示。
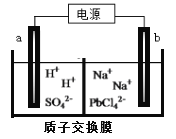
a電極的名稱是__________,b電極的電極反應式為______________________
(4)PbO2可以通過石墨為電極電解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。則陽極發生反應的電極反應式為______________,陰極上觀察到的現象是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有三種常見治療胃病藥品的標簽:

① ② ③
這三種藥品中所含的物質均能中和胃里過量的鹽酸。
(1)請寫出3種藥片中有效成分與鹽酸反應的離子方程式:
①_________________________________________________________________________;
②_________________________________________________________________________;
③_________________________________________________________________________。
(2)患胃潰瘍的患者不能服用藥片①,原因是___________________________________________________。
(3)某患者服用藥片①2片后發生打嗝現象,請計算該患者服用該藥片2片產生氣體體積約______________mL。(體積按標準狀況計算)
(4)下列關于三種藥片中和胃酸的能力比較,正確的是_______________。
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
(5)若按每片藥片中和胃酸的量來衡量藥效,則每服用藥片③1片,相當于服用藥片②________________________片。(精確到小數點后一位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列兩種說法:①一種堿溶液與一種鹽溶液混合反應后,產物之一是強堿性物質;②兩種酸溶液混合反應后,溶液的酸性減弱。其中確有具體例證存在的是 ( )
A.只有①B.①和②C.只有②D.都不存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.10mol·L-1NaOH溶液分別滴定20.00mL濃度均為0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲線如右圖。下列說法正確的是

A. 點①和點②所示溶液中:c(CH3COO-)<c(CN-)
B. 點③和點④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 點①和點②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 點②和點③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學科研小組研究在其他條件不變時,改變某一條件對化學平衡的影響,得到如下變化規律(圖中p表示壓強,T表示溫度,n表示物質的量):


根據以上規律判斷,下列結論正確的是( )
A. 反應Ⅰ:ΔH>0,p2>p1
B. 反應Ⅱ:ΔH<0,T1>T2
C. 反應Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1
D. 反應Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com