
設C+CO2 2CO(正反應吸熱),正反應的反應速率為v1;N2+3H2
2CO(正反應吸熱),正反應的反應速率為v1;N2+3H2 2NH3(正反應放熱),正反應的反應速率為v2。對于上述反應,當溫度升高時,v1和v2的變化情況為
2NH3(正反應放熱),正反應的反應速率為v2。對于上述反應,當溫度升高時,v1和v2的變化情況為
| A.v1減小,v2增大 | B.同時減小 |
| C.v1增大,v2減小 | D.同時增大 |
 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:單選題
下列關于化學反應的速率和限度的說法不正確的是( )
| A.任何可逆反應都有一定的限度 |
| B.影響化學反應速率的條件有溫度、催化劑、濃度等 |
| C.化學平衡狀態指的是反應物和生成物濃度相等時的狀態 |
| D.決定反應速率的主要因素是反應物的性質 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述不正確的是
| A.鐵生銹、白磷燃燒均為自發放熱過程 |
| B.冰融化過程其熵值增大 |
| C.高溫高壓下可以使石墨轉化為金剛石是自發的化學反應 |
| D.同一物質固態時熵值最小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
化學平衡狀態I、II、III的相關數據如下表:
| 編號 | 化學方程式 | 平衡常數 | 溫度 | |
| 979K | 1173K | |||
| I | Fe(s)+CO2(g) 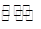 2 FeO(s)+CO(g) 2 FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| II | CO(g)+H2O(g) 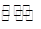 CO2(g)+H2(g) CO2(g)+H2(g) | K2 | 1.62 | b |
| III | Fe(s)+H2O(g)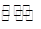 FeO(s)+H2(g) FeO(s)+H2(g) | K3 | a | 1.68 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列對“化學反應速率”的理解正確的是
| A.化學反應速率表示的是化學反應進行的限度 |
| B.化學反應速率可以用單位時間內反應物濃度的減少量來表示 |
| C.對于任何化學反應來說,反應速率越快,反應現象就越明顯 |
| D.化學反應速率可以是正值,也可以是負值 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
對于可逆反應4NH3+5O2 4NO+6H2O(g),下列敘述不正確的是 ( )
4NO+6H2O(g),下列敘述不正確的是 ( )
| A.達到平衡時,4v(O2)正=5v(NO)逆 |
| B.達到平衡狀態后,NH3、O2、NO 、H2O(g)的物質的量保持不變。 |
| C.達到平衡狀態時,若增加容器體積,則反應速率增大 |
| D.若單位時間生成xmolNO的同時,生成xmolNH3,則反應達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
工業制硫酸中的一步重要反應是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g) 2SO3(g),這是一個正反應放熱的可逆反應。如果反應在密閉容器中進行,下述有關說法中錯誤的是
2SO3(g),這是一個正反應放熱的可逆反應。如果反應在密閉容器中進行,下述有關說法中錯誤的是
| A.達到平衡時,SO2的濃度與SO3的濃度相等 |
B.相同狀況下,反應2SO3(g)  2SO2(g)+O2(g)是一個吸熱反應 2SO2(g)+O2(g)是一個吸熱反應 |
| C.為了提高SO2轉化率,可適當提高O2濃度 |
| D.升高溫度,放熱反應的速率增大,吸熱反應的速率也增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
T℃時,A氣體與B氣體反 應生成C氣體。反應過程中A、B、C濃度變化如圖(Ⅰ)所示,若保持其他條件不變,溫度分別為T1和T2時,B的體積分數與時間的關系如圖(Ⅱ)所示。現向一體積可變的密閉容器中通入等物質的量的A氣體和B氣體,在恒溫條件下發生反應達到平衡狀態Ⅰ后,再升高到某溫度,繼續反應一段時間后達到平衡狀態Ⅱ。下列敘述中正確的是( )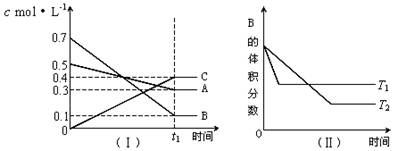
A.該反應在高溫時才能自發進行
B.反應從開始到平衡狀態Ⅰ的過程中,反應向正向進行,A的體積分數一直在減少
C.平衡狀態Ⅰ到平衡狀態Ⅱ的過程中,平衡向逆向移動,A的體積分數一直沒有變化
D.反應從開始到平衡狀態Ⅱ的過程中,平衡常數K和A的轉化率都是先增大后減少
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
100mL 6mol/L H2SO4跟過量鋅粉反應,在一定溫度,為了“減緩反應進行的速率,但又不影響生成H2的總量”,可向反應物中加入適量的 ( )
| A.Na2CO3溶液 | B.Na2CO3固體 | C.水 | D.NaNO3固體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com