
【題目】甲醚又稱甲醚,簡稱DME,熔點-141.5℃,沸點-24.9℃,與石油液化氣(LPG)相似,被譽為“21世紀的清潔燃料”。由合成氣(CO、H2)制備二甲醚的反應原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.0 kJ mol-1
CH3OH(g) △H1=-90.0 kJ mol-1
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列問題:
(1)若由合成氣(CO、H2)制備lmolCH3OCH3(g),且生成H2O(1),整個過程中放出的熱量為244kJ,則△H2=________kJ mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模擬該制備原理,500K時,在2L的密閉容器中充入2molCO和6mol H2,5min達到平衡,平衡時CO的轉化率為60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反應①的速率是_______mol·L-1·min-1,可逆反應②的平衡常數K2=_________。
若在500K時,測得容器中n(CH3OCH3)=2n(CH3OH),此時反應②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在體積一定的密閉容器中發生反應②,如果該反應的平衡常數K2值變小,下列說法正確的是_______。
A.在平衡移動過程中逆反應速率先增大后減小
B.容器中CH3OCH3的體積分數增大
C.容器中混合氣體的平均相對分子質量減小
D.達到新平衡后體系的壓強增大
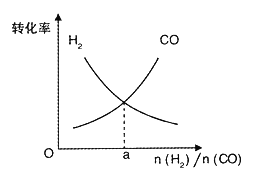
(4)一定條件下在恒溫恒容的密閉容器中,按不同投料比充入CO(g)和H2(g)進行反應①,平衡時CO(g)和H2(g)的轉化率如圖所示,則a =_________(填數值)。
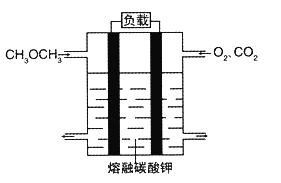
(5)綠色電源“二甲醚燃料電池”的結構圖所示,電解質為熔融態的碳酸鹽(如熔融 K2CO3),其中CO2會參與電極反應。工作時負極的電極反應為____________。該電池負極與水庫的鐵閘相連時,可以保護鐵閘不被腐蝕,這種電化學保護方法叫做__________。
【答案】 -20.0 0.24 1 < A D 2 CH3OCH3-12e-+6CO32-=8CO2↑+3H2O 外加電流的陰極保護法
【解析】(1). 已知①CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJmol-1 ,
CH3OH(g) △H1= -90.0 kJmol-1 ,
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
③H2O(l)=H2O(g) =+44.0 kJ/mol。由合成氣(CO、H2)制備1molCH3OCH3(g),且生成H2O(1),整個過程中放出的熱量為244kJ可寫出熱化學方程式為:
④2CO(g)+4H2(g)![]() CH3OCH3(g) + H2O(l) △H4 = -244 kJ mol-1
CH3OCH3(g) + H2O(l) △H4 = -244 kJ mol-1
反應④=①![]() 2+②-③,則△H4 =2△H1+△H2-△H3,所以△H2=△H4 +△H3-2△H1=-20 kJ mol-1
2+②-③,則△H4 =2△H1+△H2-△H3,所以△H2=△H4 +△H3-2△H1=-20 kJ mol-1
(2). CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始濃度(mol/L) 1 3 0
轉化量 0.6 1.2 0.3
平衡量 0.4 1.8 0.3
所以,用H2表示反應①的速率是V(H2)= ![]() =
=![]() = 0.24 mol·L-1·min-1。
= 0.24 mol·L-1·min-1。
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g)
CH3OCH3(g)+ H2O(g)
起始濃度(mol/L) 0.3 0 0
轉化量 0.1 0.2 0.2
平衡量 0.2 0.2 0.2
所以,可逆反應②的平衡常數K2= ![]() =1
=1
若在500K時,測得容器中n(CH3OCH3)=2n(CH3OH),則n(CH3OCH3)= n(H2O),Qc=![]() =4>K2,此時反應②向逆反應方向進行,所以v正<v逆。
=4>K2,此時反應②向逆反應方向進行,所以v正<v逆。
(3). 在體積一定的密閉容器中發生反應②,如果該反應的平衡常數K2值變小,由于平衡常數只受溫度影響,正反應為放熱反應,說明反應混合物體系的溫度升高了,正、逆反應速率都增大,化學平衡向逆反應方向移動了,逆反應速率逐漸減小, 正反應速率逐漸增大;由于反應前后氣體分子數不變,容器中混合氣體的平均相對分子質量不變,的物質的量減少,所以 容器中CH3OCH3的體積分數減小;
雖然氣體分子數不變,但是溫度比原平衡升高使得達到新平衡后體系的壓強增大。綜上所述,AD正確。
(4). 轉化率=![]()
![]() 100%,不同反應物的變化量之比等于化學計量數之比,所以當反應物的起始量之比等于化學計量數之比時,不同反應物的轉化率必然是相等的。所以a=2。
100%,不同反應物的變化量之比等于化學計量數之比,所以當反應物的起始量之比等于化學計量數之比時,不同反應物的轉化率必然是相等的。所以a=2。
(5). 分析二甲醚燃料電池中反應物可知,二甲醚是還原劑,氧氣是氧化劑,熔融的碳酸鉀為電解質,所以負極上是二甲醚失電子發生氧化反應生成二氧化碳和水,電極反應式為: CH3OCH3-12e-+6CO32-=8CO2↑+3H2O 。該電池負極與水庫的鐵閘相連時,可以保護鐵閘不被腐蝕,這種電化學保護方法叫做外加電流的陰極保護法。


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:
【題目】將BaO2放入密閉的真空容器中,反應2BaO2(s)![]() 2BaO(s)+O2(g)達到平衡。保持溫度不變,縮小容器容積,體系重新達到平衡,下列說法正確的是( )
2BaO(s)+O2(g)達到平衡。保持溫度不變,縮小容器容積,體系重新達到平衡,下列說法正確的是( )
A.平衡常數減小 B.BaO量不變 C.氣體密度增大 D.氧氣壓強不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 摩爾是國際單位制中的7個基本物理量之一
B. 硫酸的摩爾質量是98 g
C. 0.5molH 2 約含有3.01×1023 個氫原子
D. NA 個氧氣分子與NA 個氫氣分子的質量比為16∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】R、Q為短周期中的兩種元素,R元素原子的最外層電子數與次外層電子數之差的絕對值等于電子層數;Q元素原子的最外層電子數是次外層電子數的3倍,則下列敘述中肯定不正確的是( )。
A.原子半徑:R>Q
B.R和Q可形成離子化合物R2Q5
C.R和Q可形成共價化合物RQ
D.R和Q可形成共價化合物RO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,下列有關電解質溶液說法正確的是( )
A. 1.0mol/L NH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. 向氨水中加入NH4C1固體,溶液中![]() 增大
增大
C. 向CH3COONa溶液中滴加硫酸至中性時,c(SO42ˉ)<c(CH3COOH)
D. 下圖中曲線可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH變化情況(溶液體積變化忽略不計)。
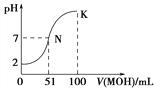
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下,Ksp[Mg(OH)2]=1.8×10-11, Ksp[Fe(OH)3]=4.0×10-38。
(1)常溫常壓下,氫氣的燃燒熱為285.8 kJ·mol-1。則氫氣燃燒的熱化學方程式為__________
(2)用離子方程式表示重鉻酸鉀在溶液中存在的平衡:__________
(3)將濃度均為0.1 mol/L的硫酸鋁溶液與小蘇打溶液混合,反應的離子方程式為__________
(4)將濃度均為0.1 mol/L的硫代硫酸鈉溶液與稀硫酸混合,反應的離子方程式為__________
(5)向Mg(OH) 2懸濁液中滴加2滴0.1 mol/L FeCl3溶液,反應的離子方程式為__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列除雜所選用的試劑及操作方法均正確的一組是(括號內為雜質)( )
選項 | 待提純的物質 | 選用的試劑 | 操作方法 |
A | NaCl(泥沙) | 水 | 過濾、結晶 |
B | CO2( CO ) | O2 | 點燃 |
C | Fe(Zn ) | 稀硫酸 | 結晶 |
D | CO2(HCl ) | NaOH溶液 | 萃取 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用電解氧化法可以在鋁制品表面形成致密、耐腐蝕的氧化膜,電解質溶液一般為H2SO4-H2C2O4混合溶液。下列敘述錯誤的是
A. 待加工鋁制品為陽極
B. 可選用不銹鋼網作為陰極
C. 陰極的電極反應式為:Al3++3e-=Al
D. 硫酸根離子在電解過程中向陽極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素。下列說法不正確的是
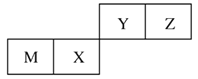
A. 原子半徑Z<M
B. Y的最高價氧化物對應水化物的酸性比X的弱
C. X的最簡單氣態氫化物的熱穩定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com