
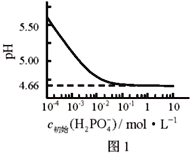
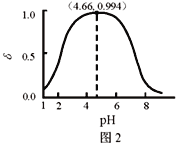
【題目】LiH2PO4是制備電池的重要原料。室溫下,LiH2PO4溶液的pH隨c初始(H2PO4–)的變化如圖1所示,H3PO4溶液中H2PO4–的分布分數![]() 隨pH的變化如圖2所示,
隨pH的變化如圖2所示,![]() 下列有關LiH2PO4溶液的敘述正確的是
下列有關LiH2PO4溶液的敘述正確的是
A. 含P元素的粒子有H2PO4–、HPO42–、PO43–
B. LiH2PO4溶液中存在2個平衡
C. 用濃度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,當pH達到4.66時,H3PO4幾乎全部轉化為LiH2PO4
D. 隨c初始(H2PO4–)增大,溶液的pH明顯變小
【答案】C
【解析】
A. H2PO4-在水溶液中既可以電離也可以水解,所以LiH2PO4溶液中含P元素的粒子有H2PO4-、HPO42–、PO43–和H3PO4,故A錯誤;
B. 溶液中存在H3PO4、H2PO4-、HPO42–、H2O的電離以及H2PO4-、HPO42–和PO43-的水解等平衡,故B錯誤;
C. 用濃度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,當pH達到4.66時,由圖2可知H2PO4-的分布分數δ達到最大,約為0.994,則H3PO4幾乎全部轉化為LiH2PO4,故C正確;
D. 由圖1可知,隨著c初始(H2PO4–)增大,溶液的pH先減小后不變,故D錯誤,答案選C。


科目:高中化學 來源: 題型:
【題目】鉬(Mo)是一種難熔稀有金屬,我國的鉬儲量居世界前列,鉬及其合金在冶金、環保和航天等方面有著廣泛的應用。
(1)Mo可被發煙硝酸及氫氟酸氧化生成X和Y(少量),X和Y中Mo價態相同,硝酸本身被還原為NO2,該反應中氧化劑與還原劑的物質的量之比為6:1,則Mo在氧化產物中的化合價為___________;
(2)已知:2Mo(s)+3O2(g)===2MoO3(s) △H1;
MoS2(s)+2O2(g)===Mo(s)+2SO2(g) △H2。
寫出MoS2(s)與氧氣反應生成MoO3(s)的熱化學方程式_____________________________;
(3)碳酸鈉作固硫劑并用氫還原輝鉬礦的原理為
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,實驗測得平衡時的有關變化曲線如圖所示。
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,實驗測得平衡時的有關變化曲線如圖所示。
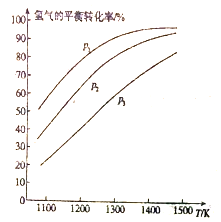
(a)不同壓強下溫度與H2平衡轉化率的關系

(b)0.1MPa下溫度與平衡時氣體成分的關系
①由圖(a)可知,該反應△H___________0(填“>”或“<”),p1、p2、p3由大到小的順序為___________;
②由圖(b)可知,B點時H2的平衡轉化率為___________;
③A點對應的平衡常數K=___________(MPa)2。(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
(4)電氧化法提純鉬的原理:將輝鉬礦(MoS2)放入裝有食鹽水的電解槽中,用惰性電極電解,MoS2被氧化為MoO42-和SO42-。
①輝鉬礦應放入電解槽的___________(填“陰極區”或“陽極區”);
②陰極的電極反應式為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】古詩詞是古人為我們留下的寶貴精神財富,下列詩句不涉及氧化還原反應的是( )
A. 粉身碎骨渾不怕,要留清白在人間
B. 野火燒不盡,春風吹又生
C. 春蠶到死絲方盡,蠟炬成灰淚始干
D. 爆竹聲中一歲除,春風送暖入屠蘇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2L的密閉容器中發生反應xA(g)+yB(g)![]() zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示200 ℃、100 ℃下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是
zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示200 ℃、100 ℃下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是
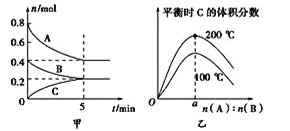
A. 200℃時,反應從開始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 若在圖甲所示的平衡狀態下再向體系中充入He,此時v正> v逆
C. 由圖乙可知,反應xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=1
zC(g)的ΔH<0,且a=1
D. 200℃時,向容器中充入2molA和1molB,達到平衡時A的體積分數小于0.5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.已知:①![]()
②![]()
③![]()
試據此寫出一氧化碳燃燒的熱化學方程式___________________________。
Ⅱ.甲乙兩池電極材料均為鐵棒與鉑棒,請回答下列問題:

(1)若電池中均為CuSO4溶液,則下列說法正確的是___________
A.一段時間后,甲乙兩池中Pt棒上都有紅色物質析出
B.甲池中Fe棒上發生氧化反應,乙池中Fe棒上發生還原反應
C.甲池中Cu2+向Fe棒移動,乙池中Cu2+向Pt棒移動
D.一段時間后,甲池中Fe棒質量減少,乙池中Fe棒質量增加
(2)若兩池中均為飽和NaCl溶液:
①寫出乙池中總反應的化學方程式_____________________________________,乙池中Pt棒上的電極反應屬于_______反應(填“氧化”或是“還原”)
②甲池中Pt棒上的電極反應式是_______________________________________
③室溫下,若乙池轉移0.02mol電子后停止實驗,該池中溶液體積為2000mL,則溶液混合均勻后pH=__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時,將3molA和1molB氣體通入體積為2L的密閉容器中(容積不變),發生如下反應:3A(g)+B(g) ![]() xC(g)。2min時反應達到平衡狀態(溫度不變),剩余了0.8molB,并測得C的濃度為0.4mol/L,請填寫下列空白:
xC(g)。2min時反應達到平衡狀態(溫度不變),剩余了0.8molB,并測得C的濃度為0.4mol/L,請填寫下列空白:
(1)x=_____________。
(2)若繼續向原平衡混合物的容器中通入少量氦氣(假設氦氣和A、B、C都不反應)后,化學平衡(填字母)________________。
A.向正反應方向移動 B. 向逆反應方向移動 C. 不移動
(3)若向原平衡混合物的容器中再充入3 molA和1 molB,在t℃時達到新的平衡,此時B轉化率___________(“變大”、“變小”或“不變”)。
(4)假如上述反應在相同溫度和容器中進行,欲使反應達到平衡時C的物質的量分數與原平衡相等,起始加入三種物質的物質的量n(A)、n(B)、n(C)之間應該滿足的關系式為_______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛的冶煉大致過程如下:
①富集:將方鉛礦(PbS)進行浮選;
②焙燒:2PbS+3O2![]() 2PbO+2SO2 ;
2PbO+2SO2 ;
③制粗鉛:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列說法錯誤的是
A. 浮選法富集方鉛礦的過程屬于物理變化
B. 將lmol PbS冶煉成Pb理論上至少需要6g碳
C. 方鉛礦焙燒反應中,PbS是還原劑,還原產物只有PbO
D. 培燒過程中,每生成lmol PbO轉移6mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.核素的種類比元素種類少
B.H2 、 D2 、T2 互為同位素,因為它們核內質子數相同,中子數不同
C.通常人們所說的 C—12 原子是指質子數和中子數都是 6 的碳原子
D.14 C 和12 C 互為同位素,兩者的化學性質不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的鎂和銅組成的混合物加入到足量的稀硝酸中,金屬完全溶解(假設反應中還原產物只有NO)。向反應后的溶液中加3mol/LNaOH溶液至沉淀完全,測得生成沉淀的質量比原合金的質量增加5.1g。下列敘述錯誤的是
A. 當金屬全部溶解時,電子轉移的數目為0.3NA
B. 參加反應的金屬的總質量3.6g<w<9.6g
C. 當金屬全部溶解時,產生的NO氣體的體積在標準狀況下為2.24L
D. 當生成的沉淀量達到最大時,消耗NaOH溶液的體積為l00mL
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com