
【題目】對氨基苯甲酸酯類是一類局部麻醉藥,化合物M是該類藥物之一。合成M的一種路線如下:
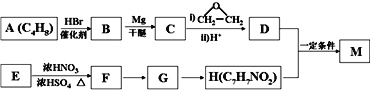
已知以下信息:
①核磁共振氫譜顯示B只有一種化學環境的氫,H苯環上有兩種化學環境的氫。
②![]()
③E為芳香烴,其相對分子質量為92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列問題:
(1)A的化學名稱是_____。
(2)由E生成F的化學方程式為_____。
(3)由G生成H的反應類型為_____。
(4)M的結構簡式為_____。
(5)D的同分異構體中不能與金屬鈉反應生成氫氣的共有_____種(不考慮立體異構),其中核磁共振氫譜只有兩組峰,且峰面積比為6∶1的是_____(寫結構簡式)。
(6)參照上述合成路線,以乙烯和環氧乙烷為原料(無機試劑任選)制備1,6-己二醛,設計合成路線_____。
【答案】 2-甲基丙烯 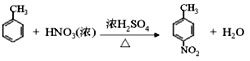 還原反應
還原反應 ![]() 15
15 ![]()
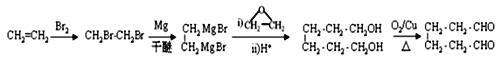
【解析】試題分析:C4H8與HBr反應的產物B只有一種化學環境的氫,說明B是(CH3)3CBr,則A是CH2=C(CH3)2;根據信息②可知,C是(CH3)3CMgBr,D是(CH3)3CCH2CH2OH;M是酯類化合物,所以H含有羧基,H分子式是C7H7NO2,苯環上有兩種化學環境的氫,則H是對氨基苯甲酸,結合E→F的反應條件是濃硫酸、濃硝酸的混合物,所以E→F是硝化反應,則E是甲苯、F是對硝基甲苯、G是對硝基苯甲酸。D、H發生酯化反應生成M,則M是![]() 。
。
解析:根據以上分析,(1)A是CH2=C(CH3)2,化學名稱是2-甲基丙烯。
(2)甲苯與濃硫酸、濃硝酸的混合物發生硝化反應生成對硝基甲苯的化學方程式為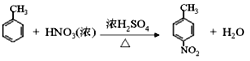 。
。
(3)由對硝基苯甲酸生成對氨基苯甲酸,硝基變為為氨基,所以反應類型為還原反應。
(4)M的結構簡式為![]() 。
。
(5)不能與金屬鈉反應說明沒有羥基, (CH3)3CCH2CH2OH的同分異構體中不能與金屬鈉反應生成氫氣有CH3O(CH2)4CH3、CH3OCH(CH3)CH2CH2CH3、CH3OCH2CH(CH3) CH2CH3、CH3OCH2CH2CH(CH3)CH3、CH3OCH(CH2CH3)2、CH3OC(CH3)2CH2CH3、CH3OCH(CH3)CH(CH3)2、CH3OCH2C (CH3)3、CH3CH2OC(CH3)3、CH3CH2O(CH2)3CH3、CH3CH2OCH(CH3)CH2CH3、CH3CH2OCH2CH(CH3)CH3、CH3CH2CH2OCH2CH2CH3、CH3CH2CH2OCH(CH3)2、![]() ,共15種(不考慮立體異構),其中核磁共振氫譜只有兩組峰,且峰面積比為6∶1的是
,共15種(不考慮立體異構),其中核磁共振氫譜只有兩組峰,且峰面積比為6∶1的是![]() 。
。
(6)乙烯與溴加成生成1,2-二溴乙烷,根據信息②,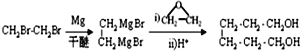 ,用銅作催化劑,
,用銅作催化劑,![]() 氧化為1,6-己二醛,合成路線是
氧化為1,6-己二醛,合成路線是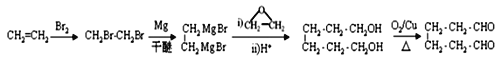


科目:高中化學 來源: 題型:
【題目】Cl2和SO2都具有漂白作用,若將等物質的量的這兩種氣體混合通入品紅與BaCl2的混合溶液中,能觀察到的現象是: ①溶液很快褪色 ②溶液不褪色 ③出現沉淀 ④不出現沉淀
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某合作學習小組討論辨析以下說法:①粗鹽和酸雨都是混合物;②純堿和熟石灰都是堿;③冰和干冰都既是純凈物又是化合物;④鹽酸和食醋既是化合物又是酸;⑤豆漿和霧都是膠體。上述說法正確的是( )
A. ①②③ B. ①②⑤ C. ③④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中a、b、c表示相應儀器中加人的試劑,可用如圖裝置制取、凈化、收集的氣體是( )
編號 | 氣體 | a | b | c |
|
A | NH3 | 濃氨水 | 生石灰 | 堿石灰 | |
B | CO2 | 鹽酸 | 碳酸鈣 | 飽和NaHCO3溶液 | |
C | NO | 稀硝酸 | 銅屑 | H2O | |
D | Cl2 | 濃鹽酸 | 二氧化錳 | 飽和NaCl溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量鋅與100mL 18.5mol/L H2SO4充分反應后,鋅完全溶解,同時生成氣體A 33.6L(標準狀況).將反應后的溶液稀釋至1L,測得溶液的氫離子濃度0.1molL﹣1 , 則下列敘述中錯誤的是( )
A.氣體A為SO2和H2的混合物
B.氣體A中SO2和H2的體積比為4:1
C.反應中共消耗Zn 97.5 g
D.反應中共轉移電子3 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在溫度、容積相同的三個密閉容器中發生反應N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下:
容器 | 甲 | 乙 | 丙 |
反應物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的濃度(mol/L) | c1 | c2 | c3 |
反應的能量變化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
體系壓強 | P1 | P2 | P3 |
反應物轉化率 | α1 | α2 | α3 |
下列說法正確的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】減少氮的氧化物和碳的氧化物在大氣中的排放是環境保護的重要內容之一。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
若某反應的平衡常數表達式為:K= ,請寫出此反應的熱化學方程式________。
,請寫出此反應的熱化學方程式________。
(2)用CH4催化還原NOx可以消除污染,若將反應CH4+2NO2=CO2+2H2O+N2設計為原電池,電池內部是摻雜氧化釔的氧化鋯晶體,可以傳導O2-,則該電池的正極反應式為________。
(3)利用H2和CO2在一定條件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)。已知不同溫度對CO2的轉化率及催化劑的效率影響如右圖所示,下列有關說法不正確的是________(填序號)。
CH2=CH2(g)+4H2O(g)。已知不同溫度對CO2的轉化率及催化劑的效率影響如右圖所示,下列有關說法不正確的是________(填序號)。

①不同條件下反應,N點的速率最大
②M點時平衡常數比N點時平衡常數大
③溫度低于250℃時,隨溫度升高乙烯的產率增大
④實際反應應盡可能在較低的溫度下進行,以提高CO2的轉化率
(4)在密閉容器中充入5 mol CO和4 mol NO,發生上述(1)中某反應,下圖為平衡時NO的體積分數與溫度、壓強的關系。

回答下列問題:
①溫度:T1________T2(填“<”或“>”)。
②某溫度下,若反應進行到10分鐘達到平衡狀態D點時,容器的體積為2 L,則此時的平衡常數K=________(結果精確到兩位小數);用CO的濃度變化表示的平均反應速率v(CO)=________。
③若在D點對反應容器升溫的同時擴大體積至體系壓強減小,重新達到的平衡狀態可能是圖中A~G點中的________點。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元索W、X、Y、Z的原子序數依次增加。Z單質是常見的黃綠色氣體,u是Y的最高價氧化物且具有兩性,v是X的最高價氧化物對應的水化物。常溫下,0.01mol·L-1 v溶液的pH為12,0.01 mol·L-1 r溶液的pH為2,上述物質的轉化關系如圖所示。下列說法正確的是
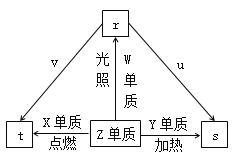
A. 單質沸點:W>Z
B. 原子半徑:X>Z>W
C. Y、Z形成的化合物中化學鍵的類型是離子鍵
D. X的簡單離子比Y的簡單離子氧化性強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com