
【題目】向平底燒瓶中放入氫氧化鋇晶體[Ba(OH)2·8H2O]和氯化銨晶體,塞緊瓶塞。在瓶底和木板間滴少量水,如下圖所示,一會兒,就會發現瓶內固態物質變稀,有液體生成,瓶壁變冷,小木板因少量水結冰凍結,而將燒瓶黏住,這時打開瓶塞,散發出來的氣體有氨味。這是自發地發生了反應:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。實驗中的下列結論正確的是( )

A. 自發反應一定是放熱反應
B. 自發反應一定是吸熱反應
C. 有的吸熱反應也能自發進行
D. 吸熱反應不能自發進行
 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案科目:高中化學 來源: 題型:
【題目】SO2是危害最為嚴重的大氣污染物之一,SO2的含量是衡量大氣污染的一個重要指標。工業上常采用催化還原法或吸收法處理SO2。催化還原SO2不僅可以消除SO2污染,而且可得到有價值的單質S。
(1)在復合組分催化劑作用下,CH4可使SO2轉化為S,同時生成CO2和H2O。已知CH4和S的燃燒熱分別為890.3kJ/mol和297.2kJ/mol,CH4和SO2反應的熱化學方程式為______________________。
(2)用H2還原SO2生成S的反應分兩步完成,如圖1所示,該過程中相關物質的物質的量濃度隨時間的變化關系如圖2所示:

①分析可知X為____________(寫化學式),0~t1時間段的溫度為_________,0~t1時間段用SO2表示的化學反應速率為________________________________。
②總反應的化學方程式為_______________________________。
(3)工業上可用Na2SO3溶液吸收SO2,該反應的離子方程式為__________________________,比較Na2SO3溶液中各離子濃度的大小關系為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿立呱陛(A)是一種新的抗精神分裂癥藥物,可由化合物B,C,D 在有機溶劑中通過以下兩條路線合成得到。
A: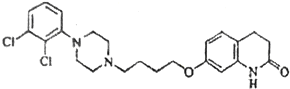
B: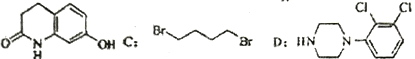
線路一:![]()
線路二:![]()
(1)E的結構簡式為______________,其含氧官能團有_________(寫名稱)。
(2)由C,D 生成化合物F 的反應類型是_____________。化合物C與足量的NaOH乙醇溶液共熱反應的產物的名稱是_________________。
(3)H 屬于氨基酸,與B 的水解產物互為同分異構體。H 能與FeCl3溶液發生顯色反應,且苯環上的一氯代物只有2 種。寫出一種滿足上述條件的H 的結構簡式_________________。
(4)合成F (相對分子質量為366) 時還可能生成一種相對分子質量為285 的副產物G,G 能使溴水褪色,G 的結構簡式為_________________。
(5)已知: 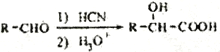 寫出由C制備
寫出由C制備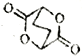 的合成路線流程圖(無機試劑任選)。合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任選)。合成路線流程圖示例如下:
 _____________________
_____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在標準狀況下8.96 L CH4的質量是__________g,含__________個氫原子。
(2)將標準狀況下22.4 L的HCl 溶于水配成200 mL的溶液,所得溶液的物質的量濃度為______________;配制300 mL 0.5 mol·L-1氯化鈉溶液,需要1.5 mol·L-1的氯化鈉溶液的體積是______________ mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一組醋酸和醋酸鈉混合溶液,溶液中c(CH3COOH)、c(CH3COO-)與pH的關系如圖所示。下列有關敘述不正確的是( )

A. pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 由圖可知該溫度下醋酸的電離常數為1×10-4.75
C. pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D. 向1 LW點所表示溶液中通入0.05 mol HCl氣體(溶液體積變化可忽略):2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)+2c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于糖類水解產物或水解過程的敘述中正確的是
A. 所有的糖類都能發生水解反應生成單糖
B. 蔗糖與麥芽糖的水解產物相同
C. 淀粉在人體內直接水解成葡萄糖
D. 在酸的催化作用下,淀粉和纖維素都可以水解成葡萄糖
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO、CO2是化石燃料燃燒的主要產物。
(1)將含002molCO2和001molCO的混合氣體通入有足量Na2O2固體的密閉容器中,同時不斷地用電火花點燃,充分反應后,固體質量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,鍵能Eo-o=499.0kJ/mol。
①反應:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K時,①中反應的平衡常數為0.40,某時刻該反應體系中各物質濃度滿足:c(CO)·c(O2)=c(CO2) ·c(O),則此時v(正)_____(填“>""<"或"=”)v(逆)。
③已知1500℃時,在密閉容器中發生反應:CO2(g)![]() CO(g)+O(g)。反應過程中O(g)的物質的量濃度隨時間的變化如圖1所示,則0~2min內,CO2的平均反應速率v(CO2)=______。
CO(g)+O(g)。反應過程中O(g)的物質的量濃度隨時間的變化如圖1所示,則0~2min內,CO2的平均反應速率v(CO2)=______。
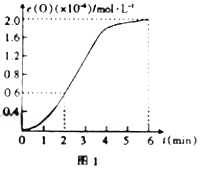
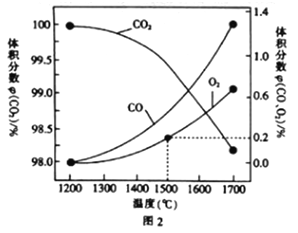
(3)在某密閉容器中發生反應:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同溫度下的平衡分解量如圖2所示。
2CO(g)+O2(g),1molCO2在不同溫度下的平衡分解量如圖2所示。
①恒溫恒容條件下,能表示該可逆反應達到平衡狀態的有___(填字母).
A.CO的體積分數保持不變
B.容器內混合氣體的密度保持不變
C.容器內混合氣體的平均摩爾質量保持不變
D.單位時間內,消耗CO的濃度等于生成CO2的濃度
②分析圖2,若1500℃時反應達到平衡狀態,且容器體積為1L,則此時反應的平衡常數K=____(計算結果保留1位小數)。
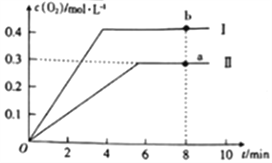
③向2L的恒容密閉容器中充入2molCO2(g),發生反應:2CO2(g)![]() 2CO(g)+O2(g),測得溫度為T℃時,容器內O2的物質的量濃度隨時間的變化如曲線II所示。圖中曲線I表示相對于曲線II僅改變一種反應條件后c(O2)隨時間的變化,則改變的條件是______;a、b兩點用CO濃度變化表示的凈反應速率關系為va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),測得溫度為T℃時,容器內O2的物質的量濃度隨時間的變化如曲線II所示。圖中曲線I表示相對于曲線II僅改變一種反應條件后c(O2)隨時間的變化,則改變的條件是______;a、b兩點用CO濃度變化表示的凈反應速率關系為va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】歐美三位科學家因“分子機器的設計與合成”研究而榮獲2016年諾貝爾化學獎。納米分子機器研究進程中常見機器的“車輪”組件如下圖所示。下列說法正確的是

A. ①③互為同系物 B. ①②③④均屬于烴
C. ①④的一氯代物均為三種 D. ②④互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的單質及其化合物性質多樣,用途廣泛。完成下列填空:
(1)用催化技術將汽車尾氣中的NO和CO轉變成CO2和N2,反應原理為:2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
某溫度下測得該反應在不同時間的CO濃度如下表:
時間(s) 濃度 ×10-3(molL-1) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
該反應平衡常數K的表達式____________________;溫度升高,K值___________(選填“增大”、“減小”、“不變”);前2s內的平均反應速率v(N2)=_______________;若上述反應在密閉容器中發生,達到平衡時能提高NO轉化率的措施之一是_________。
(2)工業合成氨的反應溫度選擇500℃左右的主要原因是______________________。
(3)在固定容積的密閉容器中,加入1mol氮氣和3mol氫氣模擬工業合成氨,反應在一定條件下已達到平衡的標志是__________________________________________________。
(4)常溫下向含1mol溶質的稀鹽酸中緩緩通入1molNH3(溶液體積變化忽略不計),反應結束后溶液呈現酸性的原因________________________________(用離子方程式表示);在通入NH3的過程中溶液的導電能力______(選填“變大”、“變小”、“幾乎不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com