
【題目】高鐵酸鈉(Na2FeO4)具有很強的氧化性,是一種新型的綠色凈水消毒劑。工業上可以通過次氯酸鈉氫化法制備高鐵酸鈉,生產過程如下:
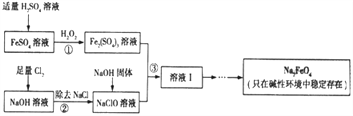
(1)高鐵酸鈉中鐵元素的化合價為____________,次氯酸鈉的電子式是__________________。
(2)鐵元素位于元素周期表的第四周期第Ⅷ族,原子序數是26,最外層有2個電子。元素鐵的原子結構示意圖是__________________。
(3)步驟①反應的離子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以單位質量得到的電子數表示)約是氯氣的_________。(計算結果保留兩位小數)
工業廢水中常含有一定量的Cr2O![]() 易被人體吸收積累而導致肝癌。處理工業含鉻廢水的方法通常是將Cr2O
易被人體吸收積累而導致肝癌。處理工業含鉻廢水的方法通常是將Cr2O![]() 轉化為Cr3+,再將Cr3+轉化為沉淀。
轉化為Cr3+,再將Cr3+轉化為沉淀。
(5)利用硫酸工業廢氣中的SO2可以處理酸性含鉻廢水,用離子方程式表示反應原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室溫下,除去被SO2還原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需調節溶液的pH至少為_________。
(7)Cr(OH)3和Al(OH)3類似,也是兩性氫氧化物。寫出Cr(OH)3的酸式電離方程式______________。
(8)Cr3+在強堿溶液中可被雙氧水氧化為CrO![]() ,發生反應的離子方程式為2Cr3++3H2O2+10OH-=2CrO
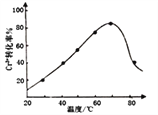
,發生反應的離子方程式為2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他條件不變,反應溫度對Cr3+轉化率的影響如圖所示。請分析溫度超過70℃時,Cr3+轉化率下降的原因是_________________________________________________。
+8H2O。控制其他條件不變,反應溫度對Cr3+轉化率的影響如圖所示。請分析溫度超過70℃時,Cr3+轉化率下降的原因是_________________________________________________。
【答案】 +6 ![]()
![]()
![]() 0.64
0.64 ![]() 6
6 ![]() 或
或![]()
![]() 雙氧水在較高溫度下發生分解,濃度降低
雙氧水在較高溫度下發生分解,濃度降低
【解析】(1)鈉元素的化合價為![]() 價,氧元素的化合價為
價,氧元素的化合價為![]() 價,根據化合價代數和為0,可得鐵元素的化合價為
價,根據化合價代數和為0,可得鐵元素的化合價為![]() 價;次氯酸鈉屬于離子化合物,由鈉離子和次氯酸根離子組成,其電子式為
價;次氯酸鈉屬于離子化合物,由鈉離子和次氯酸根離子組成,其電子式為![]() ;正確答案:+6 ;
;正確答案:+6 ;![]() 。
。
(2)鐵元素位于元素周期表的第四周期第Ⅷ族,原子序數是26,最外層有2個電子。元素鐵的原子結構示意圖是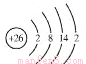 ;正確答案:
;正確答案: 。
。
(3)硫酸亞鐵被雙氧水氧化為硫酸鐵,反應的離子方程式是:![]() ;正確答案:
;正確答案:![]() 。
。
(4)根據電子得失守恒規律可知:1molNa2FeO4中鐵元素由+6價降低到+3價,得到3mol電子;1mol氯氣由0價降低到-1價,得到2 mol電子;所以:設兩種消毒劑的質量為1g,所以1gNa2FeO4得電子的量為1/166×3=0.018mol; 1g氯氣得電子的量為1/71×2=0.028mol,所以Na2FeO4的消毒效率約是氯氣的0.018/0.028=0.64 ;正確答案:0.64 。
(5)根據題給信息可知:SO2做還原劑,能夠把Cr2O![]() 還原為Cr3+;離子方程式為:
還原為Cr3+;離子方程式為:![]() ;正確答案:
;正確答案:![]() 。
。
(7)Cr(OH)3和Al(OH)3類似,也是兩性氫氧化物,Cr(OH)3的酸式電離方程式:![]() 或
或![]() ;正確答案:
;正確答案:![]() 或
或![]() 。
。
(6)根據Ksp[Cr(OH)3]=1×10-30=c(Cr3+)×c(OH-)3, c3(OH-)×1×10-6=1×10-30, c(OH-
(8)根據圖像可知:![]() ,雙氧水在較高溫度下發生分解,濃度降低;正確答案:
,雙氧水在較高溫度下發生分解,濃度降低;正確答案:![]() ,雙氧水在較高溫度下發生分解,濃度降低。
,雙氧水在較高溫度下發生分解,濃度降低。


科目:高中化學 來源: 題型:
【題目】合成神經抑制劑F的一種路線如圖所示:
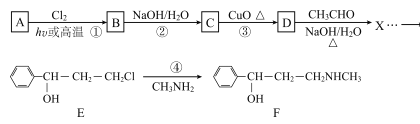
已知:![]()
請回答下列問題:
(1)已知芳香烴A的相對分子質量為92,A的結構簡式為____;B的系統命名是___ ;C中含氧官能團的名稱是____。
(2)反應③的化學反應方程式為____;①~④中屬于取代反應的是____。
(3)D分子中最多有____個原子共平面。
(4)④的反應中,因反應溫度控制不當,常常有副產物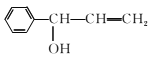 生成,寫出可能的副反應方程式____。
生成,寫出可能的副反應方程式____。
(5)包含C在內,C的同分異構體中芳香族化合物共有____種,其中滿足下列條件同分異構體的結構簡式為____。
①能使FeCl3溶液顯色,②核磁共振氫譜上有4組峰,且峰面積之比為3:2:2:1。
(6)已知-CHO與RNH2易發生反應,現以中間體X為原料,設計出制備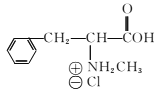 的合成路線(無機試劑自選):________________________________________
的合成路線(無機試劑自選):________________________________________
流程示例:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組根據鎂與CO2的反應設計實驗探究鎂與NO2的反應。
甲同學推測產物是MgO和N2;
乙同學推測產物除了MgO和N2外,固體中還可能含有Y。
該小組同學設計了以下裝置探究鎂與NO2反應的固體產物,并測定其組成。

(1)實驗開始時,先關閉止水夾后打開彈簧夾,再打開分液漏斗活塞,當硬質玻璃管充滿紅綜色氣體后,打開止水夾,關閉彈簧夾,最后點燃酒精燈。這樣做的目的是___________________________________________________________
(2)裝置B中的試劑可以選用________
A、濃硫酸 B、無水氯化鈣 C、五氧化二磷 D、堿石灰
(3)裝置C中盛裝氫氧化鈉溶液的作用是:___________________________________
(4)為保證生成氣體體積的準確性,讀取量筒刻度時應注意的問題是①氣體恢復至室溫再讀數;②_______________________________;③______________________________。
(5)實驗結束后,同學們將固體產物取出與水反應,發現有刺激性氣味的氣體產生,該氣體能使濕潤的石蕊試紙變藍。說明乙組同學推測正確,請寫出Y與水反應的化學方程式__________________________________
(6)若初始加入鎂粉質量為3.6 g,在足量的NO2中充分反應后 ,收集到N2體積為448mL (標準狀況),則產物中MgO的質量是_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚硅酸鐵是目前無機高分子絮凝劑研究的熱點,一種用鋼管廠的廢鐵渣(主要成分Fe3O4,少量C及SiO2)為原料制備的流程如下:
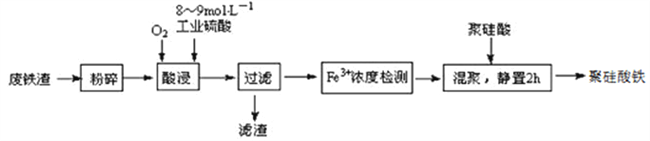
已知:在一定溫度下酸浸時Fe3+在pH=2開始沉淀,pH=3.7沉淀完全
(1)廢鐵渣進行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需適宜的酸濃度、液固比、酸浸溫度、氧流量等,其中酸浸溫度對鐵浸取率的影響如下表所示:
溫度℃ | 40 | 60 | 80 | 100 | 120 |
鐵浸取率 | 50 | 62 | 80 | 95 | 85 |
①請寫出酸浸過程中Fe3O4發生的離子反應方程式__________________________________。
②硫酸酸浸時應控制溶液的pH____________,其原因是_________________________________。
③當酸浸溫度超過100℃時,鐵浸取率反而減小,其原因是___________________。
(3)上述過濾步驟的濾液的主要成分為____________(填化學式)。
(4)Fe3+濃度定量檢則,是先用SnCl2將Fe3+還原為Fe2+;在酸性條件下,再用K2Cr2O7標準溶液滴定Fe2+(Cr2O72-被還原為Cr3+),該滴定反應的離子方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
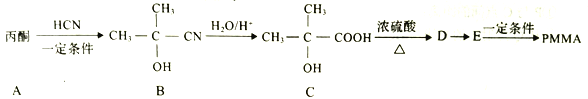
【題目】I.聚甲基丙烯酸甲酯(PMMA)俗稱有機玻璃。其結構簡式為: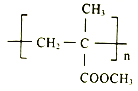 。以下是有機玻璃的一種合成路線:
。以下是有機玻璃的一種合成路線:
回答下列問題:
(1)A的結構簡式為________,A生成B的反應類型是______反應。
(2)C中官能團的名稱是________ ,D的名稱是________(系統命名法)。
(3)由E生成PMMA的化學方程式為____________。
II.由合成PMMA得到的啟示,可應用于由苯酚為主要原料制備![]()
(4)![]() 的同分異構體中符合下列條件的有_____種(不考慮立體異構):
的同分異構體中符合下列條件的有_____種(不考慮立體異構):
①屬于![]() 的二取代物
的二取代物
②取代基處于對位且完全相同
③能夠與NaHCO3溶液反應產生CO2
其中核磁共振氫譜有5個峰,峰面積之比為6:2:1:1的是_________(填結構簡式)。
(5)參照I中有機玻璃的合成路線,設計并完善![]() 的合成路線:
的合成路線:
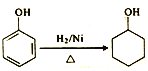 ____________
____________![]()
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、下表是某研究性學習小組探究稀硫酸與金屬鋅反應的實驗數據:

實驗數據可發現有一個數據明顯有錯誤,該數據是實驗________(填實驗序號),理由是_______________________________________________
Ⅱ、在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
(1)600℃時,在一密閉容器中,將二氧化硫和氧氣混合,反應過程中SO2、O2、SO3物質的量變化如圖,反應處于平衡狀態的時間是___________。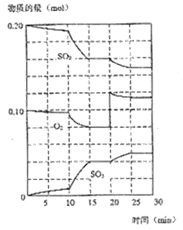
(2)據圖判斷,反應進行至20min時,曲線發生變化的原因是__________(用文字表達);10min到15min的曲線變化的原因可能是_____________(填寫編號)。
A. 加了催化劑 B. 縮小容器體積
C. 降低溫度 D. 增加SO3的物質的量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質的下列性質能肯定該物質為離子化合物的是( )
A.水溶液能導電的化合物
B.由金屬元素和非金屬元素組成的化合物
C.在熔化狀態下能導電的化合物
D.熔點高的物質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com