
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是
A. 1.0 mol NaCl固體中含有NA個NaCl分子
B. 1 mol OH—和1mol—OH(羥基)中含有的質子數均為9NA
C. 標準狀況下,0.1molCl2溶于水,轉移的電子數目為0.1NA
D. 1L0.2molL—1的NaHCO3溶液中HCO3—和CO32—離子數之和為0.2NA
 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:
【題目】下列實驗操作對應的現象、解釋或結論均正確的是( )
選項 | 實驗操作 | 實驗現象 | 解釋或結論 |
A | 將實驗室制乙烯所得的混合氣體通入酸性高錳酸鉀溶液中 | 溶液褪色 | 乙烯與酸性高錳酸鉀發生了反應 |
B | 向某無色溶液中滴加氯水和 | 下層溶液顯紫色 | 原溶液中有 |
C | 室溫下,向濃硫酸中投入鋁片 | 鋁片不溶解 | 室溫下,鋁片與濃硫酸不反應 |
D | 將3體積 | 前者產生白色沉淀,后者溶液褪色 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在3個體積均為1.0 L的恒容密閉容器中反應2H2(g)+CO(g)![]() CH3OH(g) 達到平衡。下列說法正確的是
CH3OH(g) 達到平衡。下列說法正確的是
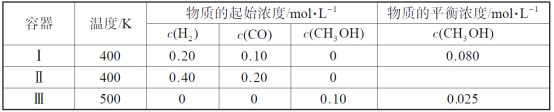
A.該反應的正反應吸熱
B.達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的大
C.達到平衡時,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的兩倍
D.達到平衡時,容器Ⅲ中的正反應速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常以黃銅礦(主要成分是CuFeS2)為原料制備銅以及副產物鐵紅(Fe2O3),兩種方法均能實現銅的冶煉,其工藝流程如圖:
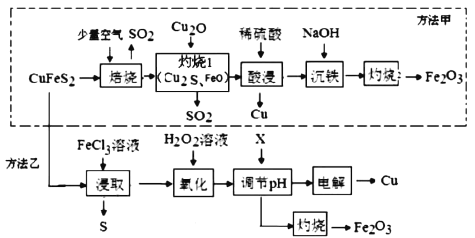
回答下列問題:
(1)為使“焙燒”反應充分進行,工業上可采取的措施是____(寫一條),寫出“焙燒”時反應的化學方程式:___。
(2)“灼燒1”工序中起氧化作用的物質是____。
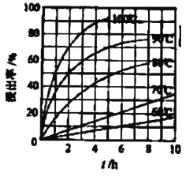
(3)FeCl3溶液“浸取”時,銅的浸出率結果如圖所示。由圖可知,當銅的浸出率為90%時,所采用的實驗條件為____,寫出該工序發生反應的離子方程式:______。
(4)“調節pH”所用試劑X是_____,該工序的目的是除去溶液中的Fe3+。當調節溶液的pH=3.5時,Fe3+______(填“是”或“不是”)沉淀完全[c(Fe3+)≤1×10-5molL-1時可認為Fe3+沉淀完全],若濾液中c(Cu2+)=0.2molL-1,此時是否有Cu(OH)2析出?_______(列式計算)。{已知:25℃時,Ksp[Fe(OH)3]=1.0×10-39、Ksp[Cu(OH)2]=2.2×10-20}
(5)方法乙比方法甲更好,其原因是_____(寫一點)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】多巴胺是一種神經傳導物質,在大腦內傳遞興奮的信息,其分子結構如下所示。下列關于多巴胺的說法不正確的是

A. 分子式為C8H11NO2
B. 能與醛類物質發生縮聚反應
C. 既能與酸反應,又能與堿反應
D. 1mol該物質最多能與2mol Br2發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,下列說法正確的是
A. CuI既是氧化產物又是還原產物
B. Cu(IO3)2作氧化劑,Cu(IO3)2中的銅和碘元素被還原
C. 每生成1 mol CuI,有12 mol KI發生氧化反應
D. 每轉移1.1 mol電子,有0.2 mol![]() 被氧化
被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有以下物質①熔融狀態的NaCl ②NH3·H2O ③Na2O固體 ④銅 ⑤BaSO4固體 ⑥酒精 ⑦液態HCl ⑧KNO3溶液,其中屬于電解質的是:___________;該狀態下能導電的是_____________;屬于非電解質的是_________________。(請用序號作答)
(2)以下A~D四個涉及H2O2的反應,請填空:
A. Na2O2+ 2HCl=H2O2+2NaCl B. Ag2O+H2O2=2Ag+O2↑+H2O
C. 2H2O2=2H2O+O2↑ D. □H2O2+□KMnO4+□H2SO4→□MnSO4+□K2SO4+□H2O+□O2↑
①配平D方程式,系數填在方框內____;該反應的還原劑是_________________;
②H2O2既體現氧化性,又體現還原性的反應是________,H2O2既不作氧化劑又不作還原劑的反應是__________。(請用代號作答)
③請用雙線橋法表示B反應中電子轉移的方向和數目:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的Fe、Fe2O3和CuO的混合物,放入體積為100 mL物質的量濃度為2.2 mol/L的H2SO4溶液中,充分反應后,生成氣體896mL(標準狀況),得到不溶固體1.28 g。過濾后,濾液中的金屬離子只有Fe2+(假設濾液體積仍為100mL)。向濾液中加入2 mol/L NaOH溶液至40mL時開始出現沉淀。則未滴加NaOH溶液前濾液中FeSO4的物質的量濃度為
A. 1.8 mol/LB. 2 mol/LC. 2.2 mol/LD. 無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學--選修5:有機化學基礎]
氰基丙烯酸酯在堿性條件下能快速聚合為 ,從而具有膠黏性,某種氰基丙烯酸酯(G)的合成路線如下:
,從而具有膠黏性,某種氰基丙烯酸酯(G)的合成路線如下:
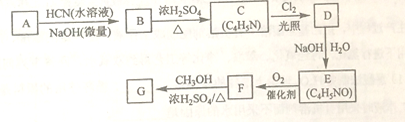
已知:
①A的相對分子量為58,氧元素質量分數為0.276,核磁共振氫譜顯示為單峰
②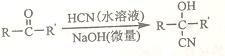
回答下列問題:
(1)A的化學名稱為_______。
(2)B的結構簡式為______,其核磁共振氫譜顯示為______組峰,峰面積比為______。
(3)由C生成D的反應類型為________。
(4)由D生成E的化學方程式為___________。
(5)G中的官能團有___、 ____ 、_____。(填官能團名稱)
(6)G的同分異構體中,與G具有相同官能團且能發生銀鏡反應的共有_____種。(不含立體異構)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com