
【題目】工業(yè)廢氣、汽車尾氣排放出的SO2、NOx等,是形成霧霾的重要因素,霾是由空氣中的灰塵、硫酸、硝酸、有機碳氫化合物等粒子形成的煙霧。
(1)NOx和SO2在空氣中存在下列平衡:
Ⅰ. 2NO(g)+O2(g)![]() 2NO2(g) H=-113.0 kJ mol-1
2NO2(g) H=-113.0 kJ mol-1
Ⅱ. 2SO2(g)+O2(g)![]() 2SO3(g) H=-196.6 kJ mol-1
2SO3(g) H=-196.6 kJ mol-1
二氧化硫通常在二氧化氮的存在下,進一步被氧化,生成三氧化硫。
①寫出NO2和SO2反應的熱化學方程式為______。
②反應Ⅱ自發(fā)進行的條件是______(填“較高溫”“較低溫”或“任何溫度”)。
(2)提高2SO2(g)+O2(g) ![]() 2SO3(g)反應中SO2的轉化率,是減少SO2排放的有效措施。
2SO3(g)反應中SO2的轉化率,是減少SO2排放的有效措施。
①T溫度時,在2L的密閉容器中加入2.0mol SO2和1.0mol O2,5min后反應達到平衡,二氧化硫的轉化率為50%,該反應的平衡常數是______。
②在①中條件下,反應達到平衡后改變下列條件,能使SO2的轉化率提高的是______(填字母)。
a.溫度和容器體積不變,充入1.0mol He
b.溫度和容器體積不變,充入1.0mol O2
c.在其他條件不變時,減少容器的體積
d.在其他條件不變時,改用高效催化劑
e.在其他條件不變時,升高體系溫度
(3)電解NO制備NH4NO3,其工作原理如圖所示。陽極的電極反應式為_____________________________,為使電解產物全部轉化為NH4NO3,需補充物質是_____。

【答案】SO2(g)+NO2(g)![]() SO3(g)+NO(g) H= -41.8 kJ mol-1 較低溫 4 b c NO - 3e- + 2H2O = NO3- + 4H+ NH3
SO3(g)+NO(g) H= -41.8 kJ mol-1 較低溫 4 b c NO - 3e- + 2H2O = NO3- + 4H+ NH3
【解析】
(1) ①Ⅰ. 2NO(g)+O2(g)![]() 2NO2(g) H=-113.0 kJ mol-1,Ⅱ. 2SO2(g)+O2(g)
2NO2(g) H=-113.0 kJ mol-1,Ⅱ. 2SO2(g)+O2(g)![]() 2SO3(g) H=-196.6 kJ mol-1,根據蓋斯定律分析,有(Ⅱ-Ⅰ)/2得熱化學方程式為: SO2(g)+NO2(g)
2SO3(g) H=-196.6 kJ mol-1,根據蓋斯定律分析,有(Ⅱ-Ⅰ)/2得熱化學方程式為: SO2(g)+NO2(g)![]() SO3(g)+NO(g) H=(-196.6kJ/mol+113.0kJ/mol)/2= -41.8 kJ mol-1 。 ② 反應Ⅱ為放熱反應,熵減,根據△G=△H-T△S分析,所以該反應在低溫自發(fā)進行。(2)
SO3(g)+NO(g) H=(-196.6kJ/mol+113.0kJ/mol)/2= -41.8 kJ mol-1 。 ② 反應Ⅱ為放熱反應,熵減,根據△G=△H-T△S分析,所以該反應在低溫自發(fā)進行。(2)
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
起始物質的量濃度 1.0 0.5 0
改變物質的量濃度 0.5 0.25 0.5
平衡時物質的量濃度0.5 0.25 0.5
則平衡常數為![]() =4。 ②a.溫度和容器體積不變,充入1.0mol He,平衡不移動,不能提高二氧化硫的轉化率,故錯誤;b.溫度和容器體積不變,充入1.0mol O2,平衡正向移動,提高二氧化硫的轉化率,故正確;c.在其他條件不變時,減少容器的體積,相當于加壓,平衡正向移動,提高二氧化硫的轉化率,故正確;d.在其他條件不變時,改用高效催化劑,平衡不移動,不能提高轉化率,故錯誤;e.在其他條件不變時,升高體系溫度,平衡逆向移動,二氧化硫的轉化率降低,故錯誤。故選b c。 (5)從圖分析,一氧化氮分別變?yōu)殇@根離子和硝酸根離子,一氧化氮在陽極失去電子,化合價升高,所以生成硝酸根離子,電極反應為: NO - 3e- + 2H2O = NO3- + 4H+ ,根據電子守恒分析,一氧化氮轉化為硝酸根離子失去3個電子,一氧化氮轉化為銨根離子得到5個電子,所以反應過程中生成的硝酸根離子比銨根離子多,為了生成硝酸銨,所以需要通入氨氣。
=4。 ②a.溫度和容器體積不變,充入1.0mol He,平衡不移動,不能提高二氧化硫的轉化率,故錯誤;b.溫度和容器體積不變,充入1.0mol O2,平衡正向移動,提高二氧化硫的轉化率,故正確;c.在其他條件不變時,減少容器的體積,相當于加壓,平衡正向移動,提高二氧化硫的轉化率,故正確;d.在其他條件不變時,改用高效催化劑,平衡不移動,不能提高轉化率,故錯誤;e.在其他條件不變時,升高體系溫度,平衡逆向移動,二氧化硫的轉化率降低,故錯誤。故選b c。 (5)從圖分析,一氧化氮分別變?yōu)殇@根離子和硝酸根離子,一氧化氮在陽極失去電子,化合價升高,所以生成硝酸根離子,電極反應為: NO - 3e- + 2H2O = NO3- + 4H+ ,根據電子守恒分析,一氧化氮轉化為硝酸根離子失去3個電子,一氧化氮轉化為銨根離子得到5個電子,所以反應過程中生成的硝酸根離子比銨根離子多,為了生成硝酸銨,所以需要通入氨氣。


科目:高中化學 來源: 題型:
【題目】下列反應屬于吸熱反應的是( )
A. 生石灰與水的反應B. 甲烷在氧氣中燃燒
C. Fe與稀鹽酸的反應D. Ba(OH)2·8H2O和NH4 Cl(固體)反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】摩爾質量為Mg·mol-1的氣態(tài)化合物VL (已換算成標準狀況) 溶于mg 水中,得到溶液的溶質質量分數為ω%,物質的量濃度為cmol·L-1,密度為ρg·cm-3,則下列說法正確的是( )
A. M 可表示為![]() B. c 可表示為
B. c 可表示為![]()
C. ω%可表示為![]() D. ρ可表示為
D. ρ可表示為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,部分物質的電離平衡常數如表所示:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8molL﹣1 |
請回答下列問題:
(1)同濃度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣結合H+的能力由強到弱的順序為________。
(2)常溫下0.1molL﹣1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是________(填字母序號,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c(OH-)/ c(H+) E.c(H+)c(CH3COO-)/ c(CH3COOH)
若該溶液升高溫度,上述5種表達式的數據增大的是________。
(3)體積為10mL pH=2的醋酸溶液與一元酸HX溶液分別加水稀釋至1000mL,稀釋過程pH變化如圖:

則HX的電離平衡常數________(填“大于”、“等于”或“小于”)醋酸的平衡常數.稀釋后,HX溶液中由水電離出來的c(H+)________(填“大于”、“等于”或“小于”)醋酸的溶液中由水電離出來的c(H+),理由是____________________。
(4)已知100℃時,水的離子積為1×10﹣12, 該溫度下測得某溶液pH=7,該溶液顯________(填“酸”、“堿”或“中”)性.將此溫度下pH=1的H2SO4溶液aL與pH=11的NaOH溶液bL混合,若所得混合液pH=2,則a∶b=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組用如圖裝置進行實驗,試回答下列問題:

(1)若開始時開關K與a連接,則B極的電極反應式為______________。
(2)若開始時開關K與b連接,則B極的電極反應式為__________,總反應的離子方程式為____________。
(3)若開始時開關K與b連接.下列說法正確的是_______。
A.溶液中Na+向A極移動
B.從A極處逸出的氣體能使?jié)駶櫟?/span>KI淀粉試紙變藍
C.反應一段時間后加適量鹽酸可恢復到電解前電解質的濃度
D.若標準狀況下B極產生2.24 L氣體,則溶液中轉移0.2 mol電子
(4)該小組同學認為,如果模擬工業(yè)上離子交換膜法制燒堿的方法,那么可以設想用如圖裝置電解硫酸鉀溶液來制取氫氣、氧氣、硫酸和氫氧化鉀。
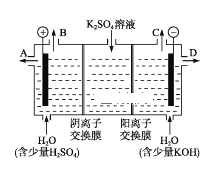
①該電解槽的陽極反應式為________。
②制得的氫氧化鉀溶液從出口(填“A”、“B”、“C”或 “D”)________導出。
③電解過程中陰極區(qū)堿性明顯增強,用平衡移動原理解釋原因_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修2:化學與技術]
高錳酸鉀(![]() )是一種常用氧化劑,主要用于化工、防腐及制藥工業(yè)等。以軟錳礦(主要成分為MnO2)為原料生產高錳酸鉀的工藝路線如下:
)是一種常用氧化劑,主要用于化工、防腐及制藥工業(yè)等。以軟錳礦(主要成分為MnO2)為原料生產高錳酸鉀的工藝路線如下:
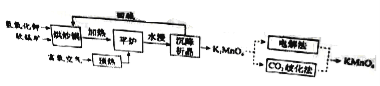
回答下列問題:
(1)原料軟錳礦與氫氧化鉀按1∶1的比例在“烘炒鍋”中混配,混配前應將軟錳礦粉碎,其作用是 。
(2)“平爐”中發(fā)生的化學方程式為 。
(3)“平爐”中需要加壓,其目的是 。
(4)將K2MnO4轉化為KMnO4的生產有兩種工藝。
①“![]() 歧化法”是傳統(tǒng)工藝,即在K2MnO4溶液中通入CO2氣體,使體系呈中性或弱堿性,K2MnO4發(fā)生歧化反應,反應中生成K2MnO4,MnO2和 (寫化學式)。
歧化法”是傳統(tǒng)工藝,即在K2MnO4溶液中通入CO2氣體,使體系呈中性或弱堿性,K2MnO4發(fā)生歧化反應,反應中生成K2MnO4,MnO2和 (寫化學式)。
②“電解法”為現代工藝,即電解K2MnO4水溶液,電解槽中陽極發(fā)生的電極反應為
,陰極逸出的氣體是 。
③“電解法”和“![]() 歧化法”中,K2MnO4的理論利用率之比為 。
歧化法”中,K2MnO4的理論利用率之比為 。
(5)高錳酸鉀純度的測定:稱取1.0800 g樣品,溶解后定容于100 mL容量瓶中,搖勻。取濃度為0.2000 mol·L1的H2C2O4標準溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的體積為24.48 mL,該樣品的純度為
(列出計算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】秸稈(含多糖物質)的綜合應用具有重要的意義。下面是以秸稈為原料合成聚酯類高分子化合物的路線:

回答下列問題:
(1)下列關于糖類的說法正確的是______________。(填標號)
a.糖類都有甜味,具有CnH2mOm的通式
b.麥芽糖水解生成互為同分異構體的葡萄糖和果糖
c.用銀鏡反應不能判斷淀粉水解是否完全
d.淀粉和纖維素都屬于多糖類天然高分子化合物
(2)B生成C的反應類型為______。
(3)D中官能團名稱為______,D生成E的反應類型為______。
(4)F 的化學名稱是______,由F生成G的化學方程式為______。
(5)具有一種官能團的二取代芳香化合物W是E的同分異構體,0.5 mol W與足量碳酸氫鈉溶液反應生成44 gCO2,W共有______種(不含立體結構),其中核磁共振氫譜為三組峰的結構簡式為_________。
(6)參照上述合成路線,以(反,反)-2,4-己二烯和C2H4為原料(無機試劑任選),設計制備對二苯二甲酸的合成路線_______________________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com