

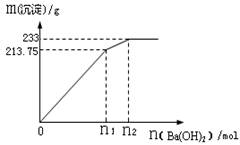
 4NO+6H2O (2分)
4NO+6H2O (2分) 4NO+6H2O;
4NO+6H2O; 4NO+6H2O,
4NO+6H2O, 4NO+6H2O
4NO+6H2O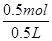 =1mol/L,故答案為:明礬或白礬;1mol/L.
=1mol/L,故答案為:明礬或白礬;1mol/L.

 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:不詳 題型:單選題
| A.黃銅(銅鋅合金)制作的銅鑼不易產生銅綠 |
| B.生鐵比軟鐵芯(幾乎是純鐵)容易生銹 |
| C.鐵質器件附有銅質配件,在接觸處易生鐵銹 |
| D.銀質獎牌久置表面變暗 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.在潮濕的酸性土壤中 | B.在潮濕不透氣的中性土壤中 |
| C.在干燥致密不透氣的土壤中 | D.在潮濕透氣的鹽堿地中 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
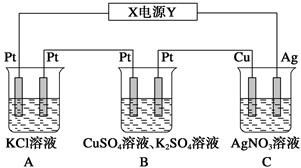
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
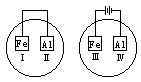
| A.II和Ⅳ | B.Ⅱ和Ⅲ | C.Ⅰ和Ⅲ | D.Ⅰ和Ⅳ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
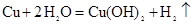 發生的是
發生的是| A.銅片作負極,碳棒作正極,氯化鈉作電解質溶液 |
| B.銅鋅合金在潮濕空氣中發生電化學腐蝕 |
| C.用銅片作陰、陽電極,電解硫酸銅溶液 |
| D.用銅片作陰、陽電極,電解硫酸鈉溶液 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
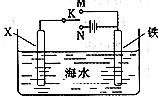
 處,該電化學防護法稱為 。
處,該電化學防護法稱為 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com