
【題目】將物質X逐漸加入(或通入)Y溶液中,生成沉淀的量與加入X的物質的量關系如圖所示,符合圖示情況的是( )

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
【答案】B
【解析】A、石灰水中通入二氧化碳,先發生反應Ca(OH)2+CO2=CaCO3↓+H2O,生成CaCO3沉淀,Ca(OH)2反應完后,繼續通入CO2反應CaCO3+CO2+H2O=Ca(HCO3)2,沉淀消失,前后兩個過程CO2的物質的量之比為1:1,A項錯誤;B、偏鋁酸鈉溶液中加入鹽酸,先發生反應AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,當偏鋁酸鈉溶液反應完后,再繼續加入鹽酸發生反應Al(OH)3+3H+=Al3++3H2O,沉淀消失,前后兩個過程HCl的物質的量之比為1:3,B項錯誤;C、氯化鋁溶液中加入氫氧化鈉溶液中,先發生反應Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,當氯化鋁溶液反應完后,再滴入氫氧化鈉溶液發生反應Al(OH)3+NaOH=NaAlO2+2H2O沉淀溶解至最后消失,前后兩個過程氫氧化鈉的物質的量之比為3:1,C項正確;D.氫氧化鈉溶液中滴入氯化鋁溶液,先發生反應Al3++4OH-═AlO2-+2H2O,不生成沉淀,當氫氧化鈉溶液反應完后,再滴入氯化鋁溶液發生反應后發生AlO2-+ Al3++6H2O=4Al(OH)3↓+6H2O,生成沉淀,前后兩個過程氯化鋁的物質的量之比為3:1,D項錯誤;答案選B。


科目:高中化學 來源: 題型:
【題目】下列反應屬于吸熱反應的是( )
A.乙醇的燃燒B.鹽酸和氫氧化鈉的中和反應
C.Ba(OH)2·8H2O與NH4Cl反應D.鋅粒與稀H2SO4反應制取H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,由酸(HM)及其鹽(NaM)組成的混合溶液,起始濃度均為lmol·L-1。向該溶液中通入HC1氣體或加入NaOH固體時,溶液pH的變化曲線如圖所示。下列說法不正確的是

A. C點時,溶液中 c(Na+)=c(M-)
B. 將 D、E 點溶液混合后,c(M-)+c(HM)=2c(Na+)
C. B點時,溶液中 c(M-)>c(Na+)>c(HM)
D. A、B、C三點所表示的溶液中水電離出來的c(H+)逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列物質中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l) E.BaSO4(s) F.NaHSO4(s) G.石墨(s) H.蔗糖(s) I.NaOH(l)
屬于非電解質的是_________,屬于強電解質的是_________,能直接導電的是____________________,能溶于水,且水溶液能導電的是________________。
(2)將6g CH3COOH溶于水制成1L溶液,此溶液的物質的量濃度為________,經測定溶液中含CH3COO-為1.4×10-3mol/L,此溫度下醋酸的電離常數:Ka=____________,溫度升高Ka將____________(填“變大”、“不變”或“變小”)。
(3)Al(OH)3的電離方程式可表示為:H++AlO![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。試根據平衡移動原理,解釋下列有關的問題。
Al3++3OH-。試根據平衡移動原理,解釋下列有關的問題。
a、向Al(OH)3沉淀中加入鹽酸,沉淀溶解,其原因是_______________________,有關的離子方程式為________________________________。
b、向Al(OH)3沉淀中加入苛性鈉溶液,沉淀溶解,其原因是_____________________,有關的離子方程式為____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于Na2CO3和NaHCO3比較中,下列說法不正確的是
A. NaHCO3固體受熱容易分解,而Na2CO3固體受熱不容易分解
B. 等質量的Na2CO3和NaHCO3分別與足量的鹽酸反應,前者消耗鹽酸的物質的量比后者多
C. 等物質的量濃度的Na2CO3和NaHCO3溶液分別滴加2滴酚酞試液,前者顏色比后者深
D. Na2CO3溶液和NaHCO3溶液分別與Ba(OH)2溶液反應的離子方程式相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2回收資源化利用是環保領域研宄的熱點課題,
(1)在FeO催化下,以CO2為原料制取炭黑(C)的太陽能工藝如圖1所示。
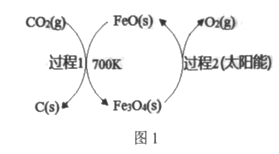
己知:①過程1生成lmolC(s)的反應熱為△H1。
②過程2反應:Fe3O4(s)![]() 3FeO(s)+l/2O2(g) △H2。
3FeO(s)+l/2O2(g) △H2。
上述以CO2為原料制取炭黑總反應的熱化學方程式為____________,若該反應的△S<0,請判斷
該反應是否為自發反應并說明理由___________________。
(2)以CO2為原料可以催化加氫合成低碳烯烴,利用CO2合成乙烯的反應方程式為:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H3。在常壓下,以 FeCoMnK/BeO 作催化劑,按n(CO2): n(H2)=l:3(總物質的量為4amol)的投料比充入密閉容器中發生反應。測得溫度對CO2的平衡轉化率和催化劑催化效率影響情況如圖2所示。
C2H4(g)+4H2O(g) △H3。在常壓下,以 FeCoMnK/BeO 作催化劑,按n(CO2): n(H2)=l:3(總物質的量為4amol)的投料比充入密閉容器中發生反應。測得溫度對CO2的平衡轉化率和催化劑催化效率影響情況如圖2所示。

①下列說法不正確的是______________。
A. △H3<0;平衡常數:KM >KN
B.增加原催化劑的表面積,對平衡轉化率無影響
C.生成乙烯的速率:v(M)有可能小于v(N)
D.若投料比改為n(CO2):n(H2)=1:2,可以提高CO2的平衡轉化率
E.若投料比不變,溫度越低,反應一定時間后CO2的轉化率越高
②250℃下,上述反應達平衡時容器體積為VL,則此溫度下該反應的平衡常數為___________(用含a、V的代數式表示)。
③某溫度下,n(C2H4)隨時間(t)的變化趨勢曲線如圖3所示。其它條件相同時,若容器的體積為其一半,畫出0~t1時刻n(C2H4)隨時間(t)的變化趨勢曲線。______
(3)以稀硫酸為電解質溶液,利用太陽能可將CO2電解轉化為低碳烯烴,則電解生成丙烯時,陰極的電極反應為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)完成下列表格
主要物質 | 雜質 | 除雜試劑 | 操作名稱 |
CO2氣體 | HCl氣體 | _______ | _______ |
FeCl2溶液 | CuCl2 | _______ | _______ |
水 | 花生油 | _______ |
(2)用雙線橋法表述(只標注電子轉移情況):MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O___________。
MnCl2+Cl2↑+2H2O___________。
用單線橋法表述電子轉移情況:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O___________。
(3)用所給量的符號和必要的數據,按要求列出相關計算式:
①摩爾質量為M,氣體摩爾體積為Vm,則氣體體積V與氣體質量m的關系___________。
②物質的量濃度為c,溶質摩爾質量為M,則溶液體積V與所含溶質質量m的關系____。
③溶質摩爾質量為M,溶液密度為dg/ml,則物質的量濃度c與溶質質量分數a%的關系c=__。
④摩爾質量為M,氣體摩爾體積為Vm,則氣體的密度=______________。
⑤某條件下氣體摩爾體積為Vm,將V升某氣體(摩爾質量為M)溶于1升水,得到密度為dg/mL的溶液,則該溶液的物質的量濃度c=_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com