
【題目】生活中處處有化學,下列有關說法正確的是
A.天然弱堿性水呈堿性的原因是其中含有較多的Mg2+、Ca2+等離子
B.焊接時用NH4Cl溶液除銹與鹽類水解無關
C.生活中用電解食鹽水的方法制取消毒液,運用了鹽類的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的紅色逐漸褪去
【答案】D
【解析】
試題A.天然弱堿性水呈堿性的原因是其中含有較多的CO32-,該離子在水中發生水解反應消耗水電離產生的H+,最終當達到平衡時,水中c(OH-)>c(H+),錯誤;B.焊接時用NH4Cl溶液除銹是由于該鹽是強酸弱堿鹽,NH4+發生水解反應小于水電離產生的OH-,當最終達到平衡時,水中c(OH-)<c(H+),溶液顯酸性,H+與金屬氧化物發生反應產生可溶性的物質,從而達到除銹的目的,與鹽類水解有關,錯誤;C.生活中用電解食鹽水的方法制取消毒液,是由于發生反應:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,產生的氯氣與堿發生反應:Cl2+2NaOH=NaCl+NaClO+H2O,產生了具有殺菌消毒作用的NaClO,與鹽類的水解無關,錯誤;D.Na2CO3是強堿弱酸鹽,在溶液中CO32-發生水解反應消耗水電離產生的H+,最終當達到平衡時,水中c(OH-)>c(H+),所以滴入酚酞試液時,溶液變為紅色。當向其中慢慢滴入BaCl2溶液,發生離子反應:Ba2++CO32-=BaCO3↓,使鹽的水解平衡逆向移動,c(OH-)減小,所以溶液的紅色逐漸褪去,正確。
Cl2↑+H2↑+2NaOH,產生的氯氣與堿發生反應:Cl2+2NaOH=NaCl+NaClO+H2O,產生了具有殺菌消毒作用的NaClO,與鹽類的水解無關,錯誤;D.Na2CO3是強堿弱酸鹽,在溶液中CO32-發生水解反應消耗水電離產生的H+,最終當達到平衡時,水中c(OH-)>c(H+),所以滴入酚酞試液時,溶液變為紅色。當向其中慢慢滴入BaCl2溶液,發生離子反應:Ba2++CO32-=BaCO3↓,使鹽的水解平衡逆向移動,c(OH-)減小,所以溶液的紅色逐漸褪去,正確。


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】目前我國主要采用硫酸法生產鈦白(TiO2),每年產生至少100萬噸鈦白廢液,其中含H2SO4約20%,還有少量Fe2+、TiO2+、Al3+。利用鈦白廢液浸出氧化鋅生產七水硫酸鋅,具有原料易得、工藝簡單、回收率高和產品純度高等優點。生產流程簡化如下:

回答下列問題:
(1)“浸出”時發生的主要反應的離子方程式為_______。
(2)為尋找“浸出”的最佳條件,做9組對比實驗得下表:
因素 | 溫度/℃ | 反應時間/h | 固液比 | 產率/% |
1 | 70 | 2 | 1∶6.5 | 79.83 |
2 | 70 | 3 | 1∶7.5 | 86.18 |
3 | 70 | 4 | 1∶8.5 | 84.33 |
4 | 80 | 2 | 1∶7.5 | 83.06 |
5 | 80 | 3 | 1∶8.5 | 87.02 |
6 | 80 | 4 | 1∶6.5 | 95.38 |
7 | 90 | 2 | 1∶8.5 | 83.58 |
8 | 90 | 3 | 1∶6.5 | 88.95 |
9 | 90 | 4 | 1∶7.5 | 89.64 |
由表中數據可知,“浸出率”最高時的反應條件是_______。
(3)從生產實際考慮,調濾液的pH時選擇加入石灰乳的原因是_______。
(4)常溫下,按1:6固液質量比反應的浸出液中鋅離子濃度最大值約為2.5mol/L,若Ksp[Zn(OH)2]=1.2×10-17,lg4.8≈0.68。則加入石灰乳調節的pH應不超過______(保留一位小數)。
(5)在加熱下鼔入空氣時,發生反應的化學方程式是___,此時TiO2+也會水解生成H2TiO3沉淀,發生反應的離子方程式為_____。
(6)加熱下加入H2O2目的是進一步氧化除雜,氧化產物為__。抽濾得到的濾渣主要成分有___和H2TiO3(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y和Z三種元素的原子序數之和等于42。X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子。X跟Y可形成化合物X2Y3,Z元素可以形成負一價離子。請回答下列問題:
(1)X元素原子基態時的電子排布式為__________,該元素的符號是__________;
 (2)Y元素原子的價層電子的軌道表示式為________,該元素的名稱是__________;
(2)Y元素原子的價層電子的軌道表示式為________,該元素的名稱是__________;
(3)X與Z可形成化合物XZ3,該化合物的空間構型為____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金屬鋅還原為XZ3,產物還有ZnSO4和H2O,該反應的化學方程式是_________________________________________________;
(5)比較X的氫化物與同族第二、第三周期元素所形成的氫化物穩定性、沸點高低并說明理由____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在某密閉容器中發生反應:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s內c(HI)由0.1mol·L-1降到0.07mol·L-1,則下列說法正確的是( )
H2(g)+I2(g) ΔH>0,若15s內c(HI)由0.1mol·L-1降到0.07mol·L-1,則下列說法正確的是( )
A. 0~15 s內用I2表示的平均反應速率為v(I2)=0.002 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反應時間小于10 s
C. 升高溫度正反應速率加快,逆反應速率減慢
D. 減小反應體系的體積,化學反應速率加快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有mg某氣體,它由雙原子分子構成,它的摩爾質量為Mg/mol。若阿伏加德羅常數用NA表示,則:
(1)該氣體的物質的量為________mol;
(2)該氣體所含原子總數為_________個;
(3)該氣體在標準狀況下的體積為_________L;
(4)該氣體溶于水后形成VL溶液,其溶液的物質的量濃度為_________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空。下面列出了幾組物質,請將物質的合適組號填寫在空格上。
A.金剛石與石墨;B.氕與氘;C.甲烷與戊烷;D.![]() 與
與 ;E.
;E.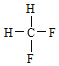 與
與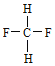 。
。
(1)同素異形體___;(2)同系物___;(3)同分異構體___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸亞鐵晶體{[CH3CH(OH)COO]2Fe·3H2O,相對分子質量為288}易溶于水,是一種很好的補鐵劑,可由乳酸[CH3 CH(OH)COOH]與FeCO3反應制得。
I.碳酸亞鐵的制備(裝置如下圖所示)

(1)儀器B的名稱是____;實驗操作如下:打開kl、k2,加入適量稀硫酸,關閉kl,使反應進行一段時間,其目的是____。
(2)接下來要使儀器C中的制備反應發生,需要進行的操作是____,其反應的離子方程式為____。
(3)儀器C中混合物經過濾、洗滌得到FeCO3沉淀,檢驗其是否洗凈的方法是____。
Ⅱ.乳酸亞鐵的制各及鐵元素含量測定
(4)向純凈FeCO3固體中加入足量乳酸溶液,在75℃下攪拌使之充分反應,經過濾,在____的條件下,經低溫蒸發等操作后,獲得乳酸亞鐵晶體。
(5)兩位同學分別用不同的方案進行鐵元素含量測定:
①甲同學通過KMnO4滴定法測定樣品中Fe2+的含量計算樣品純度。在操作均正確的前提下,所得純度總是大于l00%,其原因可能是 ___。
②乙同學經查閱資料后改用碘量法測定鐵元素的含量計算樣品純度。稱取3.000g樣品,灼燒完全灰化,加足量鹽酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL該溶液加入過量KI溶液充分反應,然后加入幾滴淀粉溶液,用0. 100 mol·L-1硫代硫酸鈉溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),當溶液____,即為滴定終點;平行滴定3次,硫代硫酸鈉溶液的平均用量為24. 80 mL,則樣品純度為____%(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人類農業生產離不開氮肥,科學合理使用氮肥,不僅能提高化肥的使用率,而且能夠更好地保護環境,請回答下列問題:
(1)將N2轉化為含氮化合物的過程稱為固氮。
①人工固氮,將N2→NH3,N2發生___反應(填“氧化”或“還原”)
②自然界固氮,可將少量N2轉化為Ca(NO3)2等氮肥,轉化途徑如下(轉化所需試劑及條件已略去):N2→NO→NO2→HNO3![]() Ca(NO3)2。
Ca(NO3)2。
寫出NO→NO2→HNO3的化學方程式___、___。
將HNO3轉化為Ca(NO3)2,列舉兩種不同類別的化合物M___(寫化學式)。
(2)科學合理地保存、施用氮肥。
①NH4HCO3需陰涼處保存,原因是___(寫化學方程式)。
②銨態氮肥不能與堿性肥料混合使用,以NH4Cl為例寫出發生反應的離子方程式___。
(3)過渡施用氮肥將導致大氣中NH3含量增高,加劇霧霾的形成。(NH4)2SO4是霧霾的成分之一,其形成過程如圖所示(轉化所需試劑及條件已略去):

①Y與NH3反應生成(NH4)2SO4的化學方程式___。
②尿素CO(NH2)2是一種常用化肥,緩慢與H2O發生非氧化還原反應釋放出NH3。則尿素中C元素化合價為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中,書寫錯誤的是( )
A.碳酸鈉溶液跟稀硫酸混合: CO32﹣+2H+=H2O+CO2↑
B.硝酸銅溶液中滴加燒堿溶液: Cu2++2OH-=Cu(OH)2↓
C.將CO2通入足量的氫氧化鈉溶液中: 2OH-+CO2=CO32﹣+H2O
D.硫酸溶液中加入Ba(OH)2溶液: Ba2++ SO![]() -=BaSO4↓
-=BaSO4↓
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com