
【題目】短周期X、Y、Z、W四種元素在元素周期表中位置如圖所示。有關表述正確的是( )

A. X、Y、W的最高價氧化物對應水化物均屬強酸
B. Y的氫化物能與Y的最高價氧化物對應水化物反應
C. 原子半徑從大到小依次為X>Z>Y>W
D. Z的氫化物的沸點低于W的氫化物
科目:高中化學 來源: 題型:
【題目】已知:實驗室常用無水乙醇(CH3CH2OH)制備乙烯,制備原理為:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
無水乙醇性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 溶解性 | 揮發性 | 化學性質 |
無水乙醇 | —114.1 | 78.3 | 能與水以任意比互溶 | 易揮發 | 能使酸性高錳酸鉀溶液褪色 |
甲、乙同學用下列實驗裝置制備乙烯并驗證其性質。(氣密性已檢驗,部分夾持裝置略)。

實驗操作和現象:
操 作 | 現 象 |
點燃酒精燈,加熱至170℃ | I:A中燒瓶內液體漸漸變黑 II:B內氣泡連續冒出,溶液逐漸褪色 |
…… | |
實驗完畢,清洗燒瓶 | III:A中燒瓶內附著少量黑色顆粒狀物,有刺激性氣味逸出 |
(1)寫出乙烯的1個用途: ,對應方程式為(注明反應類型) 。
(2)A中燒瓶內溶液“漸漸變黑”,說明濃硫酸具有 性。
(3)分析使B中溶液褪色的物質,甲認為是C2H4使B中溶液褪色,該反應的化學方程式為(注明反應類型) 。
(4)乙根據反應原理及現象I和III綜合分析,認為產物中除乙烯外還混有乙醇、H2O、CO2和一種 “有刺激性氣味”的氣體X。你認為這種“有刺激性氣味”氣體X是 (填化學式)。
為驗證氣體X的存在,并證實是C2H4使B中溶液褪色,乙設計如下裝置,與A連接:
設 計 | 現 象 |
與A連接的裝置如下:
| C中溶液褪色,加熱后又恢復紅色; F中溶液褪色 |
請回答下列問題:
D中盛放的試劑是 (填化學式),不能盛放酸性KMnO4溶液的原因是(用離子方程式解釋): 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨基甲酸銨(NH2COONH4)是一種白色固體,易分解、易水解,可用做肥料、滅火劑、洗滌劑等.某化學興趣小組用模擬制備氨基甲酸銨,反應的化學方程式如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H<0
NH2COONH4(s)△H<0
(1)制備氨基甲酸銨的裝置如圖1所示,把氨氣和二氧化碳通入四氯化碳中,不斷攪拌混合,生成的氨基甲酸銨小晶體懸浮在四氯化碳中。 當懸浮物較多時,停止制備。

注:四氯化碳與液體石蠟均為惰性介質。
①發生器用冰水冷卻的原因是__________________,液體石蠟鼓泡瓶的作用是_____________;
②從反應后的混合物中分離出產品的實驗方法是_____________(填寫操作名稱),為了得到干燥產品,應采取的方法是_____________(填寫選項序號)。
a.常壓加熱烘干 b.高壓加熱烘干 c.真空40℃以下烘干
③尾氣處理裝置如圖所示,能否將濃H2SO4改為稀H2SO4_____________(填“能”或“否”),理由是_____;

(2)取因部分變質而混有碳酸氫銨的氨基甲酸銨樣品1.570g,用足量石灰水充分處理后,使碳元素完全轉化為碳酸鈣,過濾、洗滌、干燥,測得質量為2.000g.則樣品中氨基甲酸銨的質量分數為_____________。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100].
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是由甲苯為起始原料的一系列變化,請填寫下列空白:
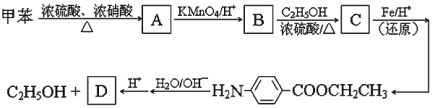
⑴ 寫出化合物 B 的結構簡式: 。
⑵ 由 B 到 C 的反應類型是 。
⑶ 任意寫出兩種同時符合下列要求的化合物 C 的同分異構體的結構簡式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯環上的一個取代基是硝基;
② 分子中含有 -COO- 結構的基團。
![]()
![]()
![]()
⑷ E、F、G 中有一種化合物經酸性水解,其中的一種產物能與FeCl3溶液發生顯色反應,這種化合物是 (在 E、F、G 中選擇,填字母)。
⑸ 一定條件下,化合物 D 發生聚合反應的化學方程式是: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組模擬工業制備純堿,方案如下:
(一)實驗原理:向飽和食鹽水中通入足量氨氣和過量二氧化碳,析出溶解度較小的碳酸氫鈉。(1)寫出相關離子方程式 。
(二)實驗裝置:所需實驗藥品和裝置如下圖所示:

(三)實驗步驟:
(2)組裝好裝置,然后應該進行的操作是 。
(3)中間的燒瓶中加入20mL飽和食鹽水,并將其浸入冰水中;D中加入足量氫氧化鈉固體,E中加入足量濃氨水;B中加入足量碳酸鈣粉末,A中加入足量稀硫酸于(可分多次加入)。儀器A的名稱是 ,選擇用稀硫酸而不用稀鹽酸的好處是 。
(4)先打開 (填K1或K2),將裝置A或E中的試劑慢慢加入圓底燒瓶。大約20分鐘左右時,觀察到飽和食鹽水上方有 現象時,再打開 (填K1或K2),將裝置A或E中的試劑慢慢加入圓底燒瓶,大約5分鐘即有渾濁出現,約15分鐘出現大量白色固體。
(四)純堿制備:
(5)上述實驗結束后,欲得到純堿,將固體過濾、洗滌后,還需進行的操作是 (不加任何其它試劑,裝置任選),反應的化學方程式為 ;若將上述操作產生的氣體全部通過濃硫酸,再通過足量的過氧化鈉,過氧化鈉增重0.28g,則制得的純堿質量為 g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置主要部分見下圖,相關物質的沸點見附表)。

附表相關物質的沸點(101kPa)

步驟1:將三頸瓶中的一定配比的無水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升溫至60℃,緩慢滴加經H2SO4干燥過的液溴,保溫反應一段時間,冷卻.
步驟2:將反應混合物緩慢加入一定量的稀鹽酸中,_________________。
步驟3:有機相用10%NaHCO3溶液洗滌,再加入適量無水MgSO4固體,放置一段時間后過濾;
步驟4:減壓蒸餾有機相,收集相應餾分。
(1)實驗裝置中可能的錯誤有______________,冷凝管進水口是______________;
(2)有同學建議將裝置中溫度計換成攪拌棒,那么溫度計應移到什么地方使用______________;
(3)步驟2后續操作是_____________;
(4)步驟3中用10%NaHCO3溶液洗滌的具體操作是____________________,加入無水MgSO4固體的作用是______________。
(5)步驟4中采用蒸餾分離,請你預測蒸餾溫度應先選擇約_______℃,再選擇約_______℃。
A.50 B.100 C.150 D.200 E.250 F.300
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積不變的密閉容器中進行反應:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各圖表示當其他條件不變時,改變某一條件對上述反應的影響,其中分析正確的是( )
2SO3(g) ΔH<0。下列各圖表示當其他條件不變時,改變某一條件對上述反應的影響,其中分析正確的是( )

A. 圖Ⅰ表示溫度對化學平衡的影響,且甲的溫度較高
B. 圖Ⅱ表示t0時刻使用催化劑對反應速率的影響
C. 圖Ⅲ表示t0時刻增大O2的濃度對反應速率的影響
D. 圖Ⅳ中a、b、c三點中只有b點已經達到化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2可作為合成低碳烯烴的原料加以利用。如:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如圖所示為在體積為1 L的恒容容器中,投料為3 mol H2和1 mol CO2時,測得的溫度對CO2的平衡轉化率和催化劑催化效率的影響。
CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如圖所示為在體積為1 L的恒容容器中,投料為3 mol H2和1 mol CO2時,測得的溫度對CO2的平衡轉化率和催化劑催化效率的影響。

已知:H2和CH2=CH2的標準燃燒熱分別是-285.8 kJ·mol-1和-1411.0 kJ·mol-1。H2O(g) ![]() H2O(l) ΔH=-44 kJ·mol-1
H2O(l) ΔH=-44 kJ·mol-1
請回答:
(1)a=__________kJ·mol-1。
(2)上述由CO2合成CH2=CH2的反應在____________下自發(填“高溫”或“低溫”),理由是____________。
(3)計算250 ℃時該反應平衡常數的數值K=____________。
(4)下列說法正確的是____________。
a.平衡常數大小:M>N
b.反應物活化分子百分數大小:M>N
c.其他條件不變,若不使用催化劑,則250℃時CO2的平衡轉化率可能位于點M1
d.其他條件不變,若投料改為4 mol H2和1 mol CO2時,則250℃時CO2的平衡轉化率可能位于點M2
e.當壓強、混合氣體的密度或n(H2)/n(CO2)不變時均可視為化學反應已達到平衡狀態
(5)保持某溫度(大于100℃)不變,在體積為V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反應物,至t0時達到化學平衡。t1時將容器體積瞬間擴大至2V L并保持不變,t2時重新達平衡。作出容器內混合氣體的平均相對分子質量![]() 隨時間變化的圖像。
隨時間變化的圖像。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬酸鈉晶體( Na2MoO4·2H2O)是一種無公害型冷卻水系統的金屬緩蝕劑。工業上利用鉬精礦(主要成分是不溶于水的MoS2)制備鉬酸鈉的兩種途徑如圖所示:

(1) NaClO的電子式是
(2) 寫出焙燒時生成MoO3的化學方程式為
(3)途徑I堿浸時發生反應的化學反應方程式為
(4)途徑Ⅱ氧化時發生反應的離子方程式為
(5)分析純的鉬酸鈉常用鉬酸銨[(NH4)2MoO4]和氫氧化鈉反應來制取,若將該反應產生的氣體與途徑I所產生的尾氣一起通入水中,得到正鹽的化學式是
(6)鉬酸鈉和月桂酰肌氨酸的混合液常作為碳素鋼的緩蝕劑。常溫下,碳素鋼在三種不同介質中的腐蝕速率實驗結果如下圖:

①要使碳素鋼的緩蝕效果最優,鉬酸鈉和月桂酰肌氨酸的濃度比應為 。
②當硫酸的濃度大于90%時,腐蝕速率幾乎為零,原因是 。
③試分析隨著鹽酸和硫酸濃度的增大,碳素鋼在兩者中腐蝕速率產生明顯差異的主要原因是 。
(7)鋰和二硫化鉬形成的二次電池的總反應為:xLi + nMoS2![]() Lix(MoS2)n。則電池放電時的正極反應式是: 。
Lix(MoS2)n。則電池放電時的正極反應式是: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com