
【題目】反應:2A(g)+3B(g)![]() C(g)+4D(g),速率最快的是( )
C(g)+4D(g),速率最快的是( )
A. v(A)=2.0mol·L-1·min-1 B. v(B)=4.0 mol·L-1·min-1
C. v(C)=0.1mol·L-1·s-1 D. v(D)=0.3mol·L-1·s-1
科目:高中化學 來源: 題型:
【題目】I.海水開發利用的部分過程如圖所示。

(1)向苦鹵中通入Cl2是為了提取溴,發生反應的離子方程式為_______________________。
(2)富集溴一般先用空氣和水蒸氣吹出單質溴,再用SO2的水溶液將其還原吸收,發生反應的化學方程式為_________________________________。也可用純堿吸收溴,主要反應是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1 mol Br2時,轉移的電子為_____ mol。
(3)下列有關海水綜合利用的說法錯誤的是_______________。
A.粗鹽可采用除雜和重結晶等過程提純
B.電解飽和食鹽水可制得金屬鈉
C.工業生產常選用Ca(OH)2作為沉淀劑
D.海水提鎂涉及到復分解反應
II. C、N、O、Na、Al、S、Cl是常見的元素。
(1)C元素位于元素周期表的位置___________________;C元素的一種同位素可以測定文物年代,這種同位素的符號為_______________。
(2)用“>”、“<”或“=”填空
離子半徑 | 酸性 | 還原性 | 得電子能力 |
N3-____ Al3+ | H2SO4____ HClO4 | O2-____ S2- | 35Cl ____37Cl |
(3)黑火藥爆炸時發生反應的化學方程式為:S+2KNO3+3C==K2S +3CO2↑+N2↑反應生成物中,屬于非電解質的是_______________,其電子式為__________________。
(4)在(3)中化學反應方程式的元素中,屬于同周期元素的非金屬性由強到弱的順序為____________________,能證明其遞變規律的事實是_______________(填字母)
A.氧化物對應水化物的酸性
B.氣態氫化物的沸點
C.單質與氫氣反應的難易程度
D.氣態氫化物的穩定性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種氣體,取X和Y按1︰1的物質的量之比混合,放入密閉容器中發生如下反應:X+2Y![]() 2Z ,達到平衡后,測得混合氣體中反應物的總物質的量與生成物的總物質的量之比為3︰2,則Y的轉化率最接近于( )
2Z ,達到平衡后,測得混合氣體中反應物的總物質的量與生成物的總物質的量之比為3︰2,則Y的轉化率最接近于( )
A. 33%B. 40%C. 50%D. 66%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置中,U形管內為紅墨水,a、b試管內分別盛有食鹽水和氯化銨溶液(呈酸性),各加入生鐵塊,放置一段時間。下列有關描述錯誤的是( )

A. 生鐵塊中的碳是原電池的正極
B. 紅墨水柱兩邊的液面變為左低右高
C. 兩試管中相同的電極反應式是:Fe →Fe2++2e-
D. a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗是化學研究的基礎。下列關于各實驗裝置的敘述正確的是( )

A. 裝置①常用于分離互不相溶的液體混合物
B. 裝置②可用于吸收NH3或HCl氣體,并防止倒吸
C. 裝置④可用于干燥、收集氯化氫,并吸收多余的氯化氫
D. 裝置③可用于收集H2、CO2、Cl2、NH3等氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空:有下列物質:①O2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩N2,回答下列問題:
(1)只含有極性鍵的是________;只含有非極性鍵的是________;含有極性鍵和非極性鍵的是________;只含有離子鍵的離子化合物是________;含有非極性鍵的離子化合物是________;
(2)寫出⑤、⑧、⑨的電子式_____________、______________、________________;
(3)溶于水只破壞離子鍵的是__________;溶于水既破壞離子鍵又破壞共價鍵的是________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D均為中學化學常見的純凈物,A是單質。它們之間有如下的反應關系:
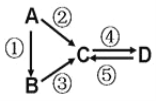
(1)若A是淡黃色固體,C、D是氧化物,且C是造成酸雨的主要物質。則C與氯水反應的化學方程式_______;
(2)若B是氣態氫化物,C、D是氧化物且會造成光化學煙霧污染。B與C在一定條件下反應生成的A是大氣主要成分,寫出該反應的化學方程式___________________;
(3)若D物質具有兩性,②③反應均要用強堿溶液,④反應是通入過量的一種引起溫室效應的主要氣體。判斷單質A的元素在周期表中的位置是_____________;
寫出反應④的離子方程式_________________;
(4)若A是應用最廣泛的金屬。④反應用到A ,②⑤反應均用到同一種非金屬單質。C的溶液用于蝕刻印刷銅電路板,寫該反應的離子方程式______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知外電路中,電子由銅流向a極。有關下圖中裝置分析合理的一項是( )
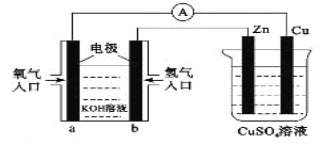
A. 一段時間后鋅片質量減少
B. 該裝之中Cu極為正極
C. b極的電極反應式:H2—2e—=2H+
D. 當銅片的質量變化為12.8g時,a極上消耗的O2在標況下的體積為2.24L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20℃時,配制一組c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)與pH的關系如右圖所示。下列指定溶液中微粒的物質的量濃度關系正確的是

A. pH=9的溶液中:c(HCO3-)>c(H2CO3)+c(CO32-)
B. c(HCO3-)= c(CO32-)的E點溶液中:c(OH-)+c(CO32-)>c(H+)+ c(H2CO3) +0.050 mol·L-1
C. pH=11的溶液中:c(Na+)<2c(CO32-)+c(HCO3-)
D. 0.100 mol·L-1的Na2CO3溶液中:c(H+)+c(H2CO3) + c(HCO3-)=c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com