
【題目】實驗室用下列方法制取氯氣:①用含4 mol 氯化氫的濃鹽酸與足量的二氧化錳反應;②用87 g 二氧化錳與足量濃鹽酸反應,若不考慮氯化氫的揮發,則反應后所得氯氣的物質的量( )
A. ①比②多 B. ②比①多 C. 兩種方法一樣多 D. 無法比較
科目:高中化學 來源: 題型:
【題目】工業生產以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為: 2NH3(g)+CO2(g) ![]() CO(NH2)2 (l)+H2O (l)。
CO(NH2)2 (l)+H2O (l)。
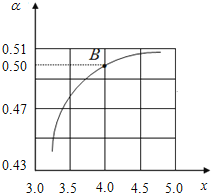
(1)T1℃時,在2L的密閉容器中充入NH3和CO2模擬工業生產,若原料氣中的NH3和CO2的物質的量之比(氨碳比)![]() =x,如圖是CO2平衡轉化率(α)與氨碳比(x)的關系。其它條件不變時,α隨著x增大而增大的原因是__________________.
=x,如圖是CO2平衡轉化率(α)與氨碳比(x)的關系。其它條件不變時,α隨著x增大而增大的原因是__________________.
(2)當x=2,上述反應至5min時各物質的濃度不再發生變化,若起始的壓強為P0KPa,測得平衡體系壓強變為起始時的![]() 。反應結束后,分離得到90g尿素。
。反應結束后,分離得到90g尿素。
試計算該反應的平均速率υ(CO2)=________________,該反應的平衡常數K=___________,達到平衡后NH3的物質的量濃度為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列生產或實驗事實引出的相應結論不正確的是
選項 | 事實 | 結論 |
A | 其他條件相同,Na2S2O3溶液和H2SO4溶液反應,升高溶液的溫度,析出硫沉淀所需時間縮短 | 當其他條件不變時,升高反應溫度,化學反應速率加快 |
B | 工業制硫酸中,在SO3的吸收階段,吸收塔里要裝填瓷環 | 增大氣液接觸面積,使SO3的吸收速率增大 |
C | 在容積可變的密閉容器中發生反應:2NH3(g) | 正反應速率加快,逆反應速率減慢 |
D | A、B兩支試管中分別加入等體積5%的H2O2溶液,在B試管中加入2~3滴FeCl3溶液,B試管中產生氣泡快 | 當其他條件不變時,催化劑可以改變化學反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為元素周期表的一部分: 
請參照元素①一⑨在周期表表中的位置,用化學用語回答下列問題:
(1)寫出元素⑥在周期表中的位置是 .
(2)元素⑤、⑧、⑨的離子半徑由大到小的順序為 .
(3)元素①④⑨形成原子個數比1:1:1化合物的電子式為;寫出元素⑤和⑧形成原子個數比2:1化合物的形成過程: .
(4)元素⑤和⑥最高價氧化物水化物反應的離子方程式為 .
(5)②的單質與⑧的最高價氧化物水化物濃溶液反應的化學方程式為 , 若反應中有6.02×1023個電子發生轉移,則生成的氣體標準狀況下的體積為L.
(6)寫出一個方程式,證明元素⑧的非金屬性比元素⑨弱: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W的原子序數依次增大。在如圖所示的物質轉化關系中,p、q、m、n分別是元素W、X、Y、Z的氣體單質,p和s均為有色氣體,v的水溶液呈堿性。常溫下,0.1molL﹣1 t溶液與0.1molL﹣1 u溶液的pH 均為1。下列說法不正確的是( )

A. Y、W的最高價氧化物對應的水化物均為強酸
B. 原子半徑:X<Z<Y
C. s溶于水的反應中,氧化劑與還原劑的物質的量之比為1:2
D. v的電子式可表示為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】符合如圖所示的轉化關系,且當X、Y、Z的物質的量相等時,存在焓變△H=△H1+△H2。滿足上述條件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,將a LNH3完全溶于水得到V mL氨水,溶液的密度為ρg·cm-3,溶質的質量分數為ω,溶質的物質的量濃度為c mol/L。下列敘述中正確的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的質量分數大于0.5ω
D. 上述溶液中再加入同體積同濃度稀鹽酸,充分反應后溶液中離子濃度大小關系為:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com