
【題目】可以將反應E+B2+=E2++B設計成原電池,下列4個電極反應: ①B﹣2e﹣=B2+
②E﹣2e﹣=E2+
③B2++2e﹣=B
④E2++2e﹣=E
其中表示負極反應和正極反應的分別是( )
A.②和③
B.②和①
C.③和①
D.④和①
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】[化學一物質結構與性質]
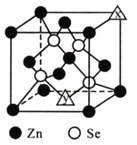
硒化鋅是一種半導體材料,回答下列問題。
(1)鋅在周期表中的位置_____________;Se基態原子價電子排布圖為___________。元素鋅、硫和硒第一電離能較大的是______________________(填元素符號)。
(2)Na2SeO3分子中Se原子的雜化類型為___________;H2SeO4的酸性比H2SeO3強,原因是_________________________________________________。
(3)氣態SeO3分子的立體構型為__________;下列與SeO3互為等電子體的有____(填序號)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化鋅的晶胞結構如圖所示,圖中X和Y點所堆積的原子均為_____(填元素符號);該晶胞中硒原子所處空隙類型為______________(填“立方體”、“正四面體”或正八面體”),該種空隙的填充率為____________;若該晶胞密度為pg·cm-3,硒化鋅的摩爾質量為Mg·mol-1。用NA代表阿伏加德羅常數的數值,則晶胞參數a為_____nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
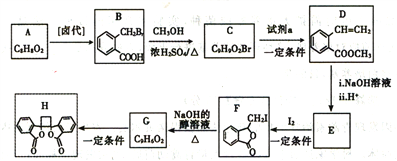
【題目】白頭翁素衍生物H是一種具有抗菌作用的化合物,實驗室由芳香化合物A制備H的一種合成路線如下:
已知:i.RCH2Br![]() R-CH=CH-R
R-CH=CH-R
ii.2R-CH=CH-R'![]()
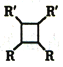 (以上R、R'代表氫或烴基等)
(以上R、R'代表氫或烴基等)
(1)A的化學名稱是_____________。C中所含官能團的名稱為_______________。
(2)試劑a是____________________,G生成H的反應類型是_____________________。
(3)由F生成G的化學方程式是_______________________________。
(4)D的同分異構體中,能同時滿足下列條件的共有_______種(不含立體結構);
①苯環上只有兩個取代基
②能使溴的四氯化碳溶液褪色
③既能發生銀鏡反應又能發生水解反應且水解產物之一能與氯化鐵溶液發生顯色反應,其中核磁共振氫譜為五組峰的有機物的結構簡式為_________________________。
(5)以乙醇為起始原料,結合已知信息選用必要的無機試劑合成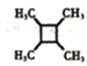 ,寫出合成路線_________________(用簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
,寫出合成路線_________________(用簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氫氣在氯氣中燃燒時產生蒼白色火焰,在反應過程中,破壞1 mol氫氣的化學鍵消耗的能量為Q1 kJ,破壞1 mol氯氣的化學鍵消耗的能量為Q2kJ ,形成1 mol氯化氫的化學鍵釋放的能量為Q3kJ,下列關系式正確的是
A. Q1 + Q2 > Q3 B. Q1 + Q2 < Q3 C. Q1 + Q2 > 2Q3 D. Q1 + Q2 < 2Q3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁石墨雙離子電池是一種全新低成本、高效電池。原理為:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。電池結構如圖所示。下列說法正確的是
Al+xC+Li++PF6-。電池結構如圖所示。下列說法正確的是

A. 放電時,外電路中電子向鋁鋰電極移動
B. 放電時,正極反應為Cx(PF6)+e-=xC+PF6-
C. 充電時,應將鋁石墨電極與電源負極相連
D. 充電時,若電路中通過1 mol電子,陰極質量增加9 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】德國化學家哈伯從1902 年開始研究由氮氣和氫氣直接合成氨,反應原理為:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒溫恒容條件下,向反應平衡體系中充入氮氣,達到新平衡時,c(H2)將_________(填“增大”、“減小”、“不變”或“無法判斷”,下同),c(N2)·c3(H2)將___________。
(2)工業上可用CH4與水蒸氣制氫氣:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃時2L的密閉容器中,將1molCH4和1mol H2O(g)混合,達平衡時CH4 的轉化率為80%。則200℃時該反應的平衡常數K=______________(保留一位小數)。
CO(g)+3H2(g)。在200℃時2L的密閉容器中,將1molCH4和1mol H2O(g)混合,達平衡時CH4 的轉化率為80%。則200℃時該反應的平衡常數K=______________(保留一位小數)。
(3)如圖為合成氨反應在不同溫度和壓強、使用相同催化劑條件下,初始時氮氣、氫氣的體積比為1:3 時,平衡混合物中氨的體積分數。若分別用vA(NH3)和vB(NH3)表示從反應開始至達平衡狀態A、B 時的化學反應速率,則vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工業生產中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,該溶液中各離子的物質的量濃度由大到小的順序是______________________。
(5)H2NCOONH4是工業合成尿素的中間產物,該反應的能量變化如圖所示,用CO2和氨合成尿素的熱化學方程式為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氮及其化合物與生活密切相關。請根據要求回答下列問題:
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-l160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
寫出CH4(g)與NO2(g)反應生成N2(g)、CO2(g)和H2O( 1) 的熱化學方程式_________。
(2)已知: 反應I: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H < 0
4NO(g)+6H2O(g) △H < 0
反應II: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H < 0
2N2(g)+6H2O(g) △H < 0
①在恒溫恒容裝置中充入一定量的NH3 和O2,在催化劑的作用下進行反應I,則下列有關敘述中正確的是___(填字母序號)。
A.增大壓強,Kp(用壓強表示的化學平衡常數) 增大
B.若測得容器內3v正(NH3)=2v逆(H2O) 時,說明反應已達平衡
C.升高溫度,NH3 的轉化率增大
D.達到平衡時體系的壓強不再變化
②氨催化氧化時會發生上述兩個競爭反應I、II。為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1molNH3和2molO2,得有關物質的量關系如圖,該催化劑在高溫時選擇反應_____(填“I”或“II”)。
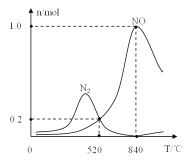
③520℃時,4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)的平衡常數K=_______(只需列出數字計算式)。提高NH3轉化為N2平衡轉化率的措施有______( 填字母序號)
2N2(g)+6H2O(g)的平衡常數K=_______(只需列出數字計算式)。提高NH3轉化為N2平衡轉化率的措施有______( 填字母序號)
A.降低反應溫度 B.將反應生成的H2O(g)及時移出
C.增大NH3和O2的初始投料比 D.投料比不變,增加反應物的濃度
(3)己知25℃時HCN 和H2CO3的電離常數(Ka.)如下表:
物質 | 電離常數(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7× 10-11 |
25℃時,測得HCN 和NaCN 的混合溶液pH=11,則c(HCN)/c(CN-)=____。向NaCN 溶液中通入少量CO2,則發生反應的離子方程式為:__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com