
【題目】科學家們對CO2的應用研究日新月異。
(1)合成尿素的原料是CO2和NH3,合成原理分兩步:
①合成氨基甲酸銨:CO2(g)+2NH3(g)===NH2COONH4(s) ΔH=-159.47 kJ/mol
②氨基甲酸銨分解:NH2COONH4(s)===CO(NH2)2(s)+H2O(l) ΔH=+28.49 kJ/mol
則2 mol CO2完全反應合成尿素所________(填“吸收”或“釋放”)的熱量為________。
(2)最近科學家們研制成功一種新型催化劑,能將CO2轉變為甲烷。在常壓,300 ℃,CO2與H2體積比為1∶4時反應,CO2轉化率達90%。
①寫出此反應的化學方程式:_______________________。
②某興趣小組,在一定條件下,在體積為V L的密閉容器中,模擬發生此反應達到化學平衡狀態。該反應的平衡常數表達式為__________________________;
由下圖可知升高溫度,K將________(填“增大”、“減小”或“不變”);300 ℃時,從反應開始到達到平衡,以H2的濃度變化表示化學反應速率:______________(用nA、tA、V表示)。

【答案】(1)釋放 261.96 kJ
(2)①CO2+4H2![]() CH4+2H2O
CH4+2H2O
②K=![]() 減小
減小 ![]() mol/(L·min)
mol/(L·min)
【解析】(1)根據蓋斯定律,①+②得CO2(g)+2NH3(g)===CO(NH2)2(s)+H2O(l) ΔH=-130.98 kJ/mol,故2 mol CO2完全反應合成尿素所釋放的熱量為261.96 kJ。(2)根據反應物的體積比及產物中有CH4,可得出此反應的化學方程式為CO2+4H2![]() CH4+2H2O;該反應的平衡常數表達式為K=
CH4+2H2O;該反應的平衡常數表達式為K=![]() ;從圖中看出該反應為放熱反應,故升高溫度,K將減小;依據化學反應速率的定義知,300 ℃時,從反應開始到達到平衡,以H2的濃度變化表示的化學反應速率是
;從圖中看出該反應為放熱反應,故升高溫度,K將減小;依據化學反應速率的定義知,300 ℃時,從反應開始到達到平衡,以H2的濃度變化表示的化學反應速率是 ![]() mol/(L·min)。
mol/(L·min)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列元素相關粒子的電子排布式中,前者一定是金屬元素,后者一定是非金屬元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知An +,B(n+1) +,Cn -,D(n+1) -離子具有相同的電子層結構,則A、B、C、D的原子半徑由大到小的順序為 ( )
A. A>B>C>D B. C>D>B>A
C. A>B>D>C D. D>C>A>B
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組為了探究甲烷和氯氣反應的情況,設計了幾個實驗。請填寫下列空白:
【實驗一】用如圖所示裝置,收集一試管甲烷和氯氣的混合氣體,照后觀察到量筒內形成一段水柱,認為有氯化氫生成。
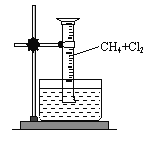
(1)該反應的反應類型為
(2)該反應的化學方程式為(只寫第一步) ;
(3)水槽中盛放的液體應為 ;(填標號)
A.水 B.飽和石灰水 C.飽和食鹽水 D.飽和NaHCO3溶液
【實驗二】收集一試管甲烷和氯氣的混合氣體,光照反應后,滴加AgNO3溶液,看到有白色沉淀生成,認為有氯化氫生成。
(4)你認為該實驗設計得出的結論是否正確的 ,
若不正確,理由是:
【實驗三】
步驟一:收集半試管氯氣,加入10 mL蒸餾水,充分振蕩,采用DIS系統的pH傳感器測溶液的pH(下同)。測得pH = 3.26
步驟二:收集一試管甲烷和氯氣的混合氣體(各占50%),在40 W的日光燈下光照6 min后,加入10 mL蒸餾水,充分振蕩,測得pH = 1.00。
(5)判斷該反應中有氯化氫生成的依據是
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為兩種途徑制備硫酸的過程,反應條件略。下列說法不正確的是

A. 途徑l發生的反應是SO2+H2O2=H2SO4
B. 途徑2增大O2的濃度可提高SO3的產率和SO2的轉化率
C. ImolS完全反應生成SO3所放出的熱量即為S的燃燒熱
D. 若△H1<△H2+△H3,則2 H2O2 (aq)=2 H2O(aq)+ O2 (g)為放熱反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com