
【題目】對于密閉容器中可逆反應 A2(g)+3B2(g)![]() 2AB3(g),探究單一條件改變情況下,可能引起平衡狀態(tài)的改變,得到如下圖所示的曲線(圖中T表示溫度,n 表示物質(zhì)的量)下列判斷正確的是
2AB3(g),探究單一條件改變情況下,可能引起平衡狀態(tài)的改變,得到如下圖所示的曲線(圖中T表示溫度,n 表示物質(zhì)的量)下列判斷正確的是

A. 加入催化劑可以使狀態(tài) d 變?yōu)闋顟B(tài) b
B. 若 T1>T2,則逆反應一定是放熱反應
C. 達到平衡時 A2 的轉(zhuǎn)化率大小為: b>a>c
D. 在T2 和n(A2)不變時達到平衡,AB3 的物質(zhì)的量大小為: c>b>a
【答案】D
【解析】
A.催化劑只能改變化學反應速率,不會改變化學平衡,由圖可知,T2時b點AB3的體積分數(shù)大于T1時d點AB3的體積分數(shù),說明平衡發(fā)生改變,不會是加入催化劑造成的,A項錯誤;B.當T1>T2時,說明升高溫度平衡逆向移動,即逆反應為吸熱反應,B項錯誤;C.在可逆反應中增加一種反應物的濃度可以提高另一種物質(zhì)的轉(zhuǎn)化率,隨著B2的量的增加,A2的轉(zhuǎn)化率逐漸增大,即c>b>a,C項錯誤;D.在T2 和n(A2)不變時,加入B2的量,平衡正向移動,AB3的物質(zhì)的量增大,則AB3 的物質(zhì)的量大小為:c>b>a,D項正確。答案選D。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種強氧化性漂白劑,廣泛用于紡織、印染和食品工業(yè)。它在堿性環(huán)境中穩(wěn)定存在。某同學查閱資料后設計生產(chǎn)NaClO2的主要流程如下。

(1)雙氧水的電子式為 ;Ⅰ中發(fā)生反應的還原劑是 (填化學式)。
(2)Ⅱ中反應的離子方程式是______________________________。
(3)ClO2是一種高效水處理劑,可用亞氯酸鈉和稀鹽酸為原料制備。
①寫出該反應的化學方程式:__________________________________;
②研究表明:若反應開始時鹽酸濃度越大,則氣體產(chǎn)物中Cl2的含量越大,運用氧化還原反應規(guī)律分析,其原因是__________________________________。
(4)NaClO2變質(zhì)可分解為NaClO3和NaCl。取等質(zhì)量變質(zhì)前后的NaClO2試樣均配成溶液,分別與足量FeSO4溶液反應時,消耗Fe2+的物質(zhì)的量 (填“相同”、“不相同”或“無法判斷”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是元素周期表的一部分,有關說法中正確的是
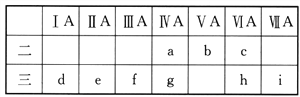
① a、b、e、f四種元素的原子半徑:e>f>b>a
② h、i兩種元素陰離子的還原性:h>i
③ a、g兩種元素的氫化物的穩(wěn)定性:a>g
④d、e、f三種元素的最高價氧化物對應的水化物堿性依次增強
⑤九種元素中d元素的單質(zhì)還原性最強
A. ①③④ B. ②③⑤ C. ②④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各原子或離子的電子排列式錯誤的是
A. Na+1s22s22p6 B. F-1s22s22p6
C. N3+ 1s22s22p6 D. O2-1s22s22p6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關萃取操作的說法中,不正確的是( )
A.實驗使用的主要儀器是分液漏斗
B.溶質(zhì)溶于萃取劑中所得的溶液不一定有顏色
C.溶質(zhì)在萃取劑中的溶解度比在原溶劑中的溶解度大
D.CCl4、苯、汽油、酒精均可萃取碘水中的碘
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請參考題中圖表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根據(jù)要求回答問題:
(1)圖Ⅰ是1 mol NO2(g)和1 mol CO(g)反應生成CO2和NO過程中的能量變化示意圖,若在反應體系中加入催化劑,反應速率增大,E1的變化是__________(填“增大”、“減小”或“不變”,下同),ΔH的變化是__________。請寫出NO2和CO反應的熱化學方程式___________________。

(2)甲醇質(zhì)子交換膜燃料電池中將甲醇蒸汽轉(zhuǎn)化為氫氣的兩種反應的熱化學方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,則甲醇蒸汽燃燒為液態(tài)水的熱化學方程式為_______________。
(3)如表所示是部分化學鍵的鍵能參數(shù):
化學鍵 | P—P | P—O | O===O | P===O |
鍵能/kJ·mol-1 | a | b | c | x |

已知白磷的燃燒熱為d kJ·mol-1,白磷及其完全燃燒的產(chǎn)物的結構如圖Ⅱ所示,則表中x=__________ kJ·mol-1(用含a、b、c、d的代表數(shù)式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高爐煉鐵是冶煉鐵的主要方法,發(fā)生的主要反應為:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反應1: Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H1
2Fe(s)+3CO(g) △H1
反應2: C(石墨,s)+CO2(g)![]() 2CO(g) △H2
2CO(g) △H2
①△H= _________(用含△H1、 △H2代數(shù)式表示)
②保持溫度不變,在恒容容器中進行反應1,達到平衡狀態(tài),再次充入一定量的CO (Fe足量),則平衡_________移動(填“正向”或“逆向”),達到新平衡后c(CO)將_________(填“變大”、“變小”或“不變”)
(2)在T℃時,反應 Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常數(shù)K=64,在2L恒容密閉容器甲和乙中,分別按下表所示加入物質(zhì),反應經(jīng)過一段時間后達到平衡。
2Fe(s)+3CO2(g)的平衡常數(shù)K=64,在2L恒容密閉容器甲和乙中,分別按下表所示加入物質(zhì),反應經(jīng)過一段時間后達到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡轉(zhuǎn)化率為_________
②下列說法正確的是_________(填字母)。
A.若容器壓強恒定,說明反應達到平衡狀態(tài)
B.增加Fe2O3的量能提高CO的轉(zhuǎn)化率
C.甲容器中CO的平衡轉(zhuǎn)化率大于乙的平衡轉(zhuǎn)化率
D.若容器中固體質(zhì)量不再改變,說明反應達到平衡狀態(tài)
③取五等份CO,分別加入溫度不同但容積相同的恒容密閉容器中(已裝有足量Fe2O3),反應相同時間后,分別測定體系中CO的體積分數(shù)(CO%),并作出其隨反應溫度(T)變化的關系圖,請在答題卡中作出平衡時混合氣體的平均相對分子質(zhì)量隨反應溫度(T)的變化示意圖。
_________

查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com