
【題目】化學反應原理在科研和生產中有廣泛應用。
(1)難揮發性TaS2可采用如下裝置提純:將不純的TaS2粉末裝入石英管一端,抽真空后引入適量碘并封管,置于加熱爐中,反應如下:TaS2(s)+2I2(g)![]() TaI4(g)+S2(g),△H>0,下列說法正確的是:_____
TaI4(g)+S2(g),△H>0,下列說法正確的是:_____

A 在提純過程中,I2的作用是將TaS2從高溫區轉移到低溫區
B 改變壓強,平衡不發生移動,所以反應放出的熱量不變
C 加入催化劑,改變了反應的途徑,反應的△H也隨之改變
D 向容器中加入更多的TaS2(s)可以提高I2(g)的轉化率
(2)在恒壓、NO和O2的起始濃度一定的條件下,催化反應相同時間,測得不同溫度下NO轉化為NO2的轉化率如圖中曲線所示。
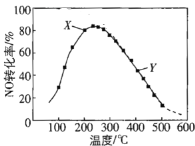
①下列說法不正確的是_____________。
A 反應2NO(g)+O2(g)![]() 2NO2(g),溫度升高NO轉化率增大說明正反應為吸熱反應
2NO2(g),溫度升高NO轉化率增大說明正反應為吸熱反應
B 圖中X點所示條件下,延長反應時間能提高NO轉化率
C 圖中Y點所示條件下,增加O2的濃度能提高NO轉化率
D 3800C下,C起始(O2)=5.0×10-4 mol·L-1,NO平衡轉化率為50%,則平衡常數K<2000
②請在上圖中畫出不同溫度下NO轉化為NO2的平衡曲線_____。
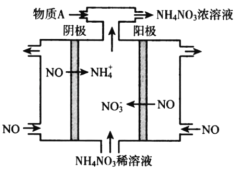
(3)電解NO可制備NH4NO3,其工作原理如下圖所示,為使電解產物全部轉化為NH4NO3,需補充物質A,A是_________,寫出電解過程的總反應化學方程式________。
【答案】AB AD 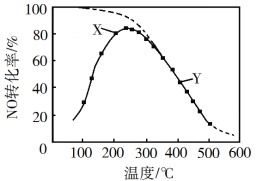 NH3 8NO+7H2O= 3NH4NO3+2HNO3,
NH3 8NO+7H2O= 3NH4NO3+2HNO3,
【解析】
⑴將TaS2與單質碘反應生成TaI4和S2,生成的產物移向另外一端石英管,在另一端石英管中反應又生成TaS2與單質碘。
⑵溫度在250C左右,轉化率達到最大值,小于250C是建立平衡的階段,大于250C是溫度升高,平衡逆向移動,說明該反應正反應是放熱反應。溫度越高轉化率越低,在低溫下達到平衡時,轉化率越高,因此圖像從最高點處逆向增大。
⑶電解NO可制備NH4NO3,陽極NO被氧化生成硝酸根離子,陰極NO被還原生成銨根離子,總的反應方程式為8NO+7H2O= 3NH4NO3+2HNO3,因此為了使電解產物全部轉化為NH4NO3,需補充物質NH3,電解過程的總反應化學方程式8NO+7H2O= NH4NO3+2HNO3。
⑴A選項,在提純過程中,I2與TaS2在高溫區反應生成TaI4和S2,生成的產物移到石英管另一端,在另一端低溫區反應生成I2和TaS2,因此I2的作用是將TaS2從高溫區轉移到低溫區,故A正確;
B選項,該反應是等體積反應,改變壓強,平衡不發生移動,所以反應放出的熱量不變,故B正確;
C選項,加入催化劑,改變了反應的途徑,但反應的△H不會改變,故C錯誤;
D選項,TaS2(s)是固體,向容器中加入更多的TaS2(s),平衡不移動,不能提高I2(g)的轉化率,故D錯誤。
綜上所述,答案為AB。
⑵①A選項,反應2NO(g)+O2(g)![]() 2NO2(g),250C以前是未達到平衡的階段,250C以后是升溫,轉化率減小,平衡逆向移動,說明正反應為放熱反應,故A錯誤,符合題意;
2NO2(g),250C以前是未達到平衡的階段,250C以后是升溫,轉化率減小,平衡逆向移動,說明正反應為放熱反應,故A錯誤,符合題意;
B選項,圖中X點是未建立平衡的點,在該條件下,延長反應時間,向正反應進行,當達到平衡時,能提高NO轉化率,故B正確,不符合題意;
C選項,圖中Y點所示條件下,增加O2的濃度,平衡正向移動,NO轉化率增大,故C正確,不符合題意;
D選項,3800C下,c起始(O2)=5.0×10-4 mol·L-1,NO平衡轉化率為50%,
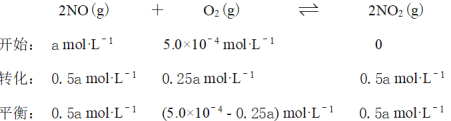
則平衡常數![]() ,故D錯誤,符合題意。
,故D錯誤,符合題意。
綜上所述,答案為AD。
②根據前面分析該反應是放熱反應,溫度越高,轉化率越小,溫度越低,轉化率越大,最高點是該溫度下達到平衡的點,后面的點沿最高點逆向上畫出平衡曲線,如圖所示,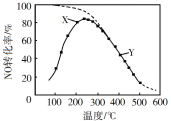 ,故答案為:
,故答案為: 。
。
⑶電解NO可制備NH4NO3,陽極發生氧化反應,NO被氧化生成硝酸根離子,陰極發生還原反應,NO被還原生成銨根離子,總的反應方程式為8NO+7H2O= 3NH4NO3+2HNO3,因此為了使電解產物全部轉化為NH4NO3,需補充物質NH3,電解過程的總反應化學方程式8NO+7H2O = 3NH4NO3+2HNO3,故答案為:NH3;8NO+7H2O= 3NH4NO3+2HNO3。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在FeCl2和CuCl2的混合溶液中加入鐵屑,反應結束后濾出固體物質,濾液中的陽離子可能是( )
①只有Fe2+;②Fe2+和Fe3+; ③Fe2+和Cu2+; ④Cu2+和![]() .
.
A.②③B.②④C.①④D.①③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】資料顯示“強酸性或強堿性溶液可使品紅溶液褪色”。某興趣小組探究SO2使品紅溶液褪色的原因,實驗如下。
Ⅰ.探究體現漂白性的主要微粒
實驗一:將SO2分別通入0.1%品紅水溶液和0.1%品紅乙醇溶液中。觀察到前者褪色而后者不褪色。
實驗二:
| 試管中的液體 | 現象 |
a.0.1mol/L SO2溶液(pH=2) | 溶液逐漸變淺,約90s后完全褪色 | |
b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即變淺,約15s后完全褪色 | |
c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
d.pH=10 NaOH溶液 | 紅色溶液不變色 | |
e.pH=2 H2SO4溶液 | 紅色溶液不變色 |
(1)SO2水溶液中含![]() 的微粒有___。
的微粒有___。
(2)解釋NaHSO3溶液顯酸性的原因是___。
(3)實驗d的目的是___。
(4)由實驗一、二可知:該實驗條件下,SO2使品紅溶液褪色時起主要作用的微粒是___。
Ⅱ.探究褪色過程的可逆性
甲同學:向a實驗后的無色溶液中滴入NaOH溶液至pH=10時,溶液顏色不變。
乙同學:向a實驗后的無色溶液中滴入Ba(OH)2溶液至pH=10時,生成白色沉淀,溶液變紅。
(5)實驗方案合理的是___(選填“甲”或“乙”)。結合離子方程式說明其原因是___。
(6)丙同學利用SO2的還原性設計并完成了下列實驗:向a實驗后的無色溶液中滴入過量___(填編號),使溶液最終恢復紅色。也得出結論:該褪色過程是可逆的。
A.稀硝酸 B.氯水 C.雙氧水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實。某化學興趣小組在實驗室中模擬上述過程,其設計的模擬裝置如下:
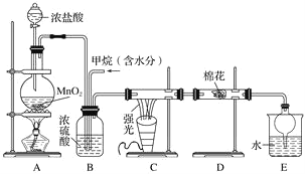
試回答下列問題:
(1)請寫出C裝置中生成CH3Cl的化學方程式:___________________________________。有人認為E中有氯化氫產生,不能證明甲烷與氯氣發生了取代反應,你認為他的看法________(填“正確”或“不正確”)。
(2)B裝置有三種功能:①控制氣流速率;②混勻混合氣體;③________________。
(3)一段時間后發現D裝置中的棉花由白色變為藍色,則棉花上可能預先滴有________溶液。
(4)E裝置中除鹽酸外,還含有機物,從E中分離出鹽酸的最佳方法為________(填字母)。
a.分液法 b.蒸餾法 c.結晶法
(5)將1 mol CH4與Cl2發生取代反應,充分反應后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四種有機產物的物質的量依次增大0.1 mol,則參加反應的Cl2的物質的量為________,生成HCl的總物質的量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某班學生對BeCl2是離子化合物還是共價化合物進行集體探究,從經驗看鈹是金屬元素,易失去電子,氯元素易得到電子,請回答以下問題:
(1)Be的電負性是1.5,Cl的電負性是3.0,則BeCl2應為_________化合物。
(2)工業上制取BeCl2方法是:將得到的BeCl2溶液在HCl氣流中蒸干灼燒,防止BeCl2水解,請寫出BeCl2水解的化學方程式__________________。
(3)經實驗驗證,熔融的BeCl2不能導電,說明它是_______化合物;BeCl2能溶于水,水溶液能導電,因它在溶液中能電離,寫出它的電離方程式_________。
(4)在周期表中,鈹元素和鋁元素恰好處于對角線位置,根據對角線法則,判斷BeCl2應與_____(填MgCl2或AlCl3)化學性質更相似。
(5)0.1mol氫氧化鈹恰好能和100mL0.2mol/L的氫氧化鈉溶液發生反應,寫出反應的化學方程式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列說法正確的是
2AB2(g) ΔH<0,下列說法正確的是
A. 達平衡后降低溫度,混合氣體平均相對分子質量減小
B. 使用催化劑能加快反應速率,縮短達平衡所需的時間且提高A2的轉化率
C. 達平衡后升高溫度并增大壓強,有可能每一組分的百分含量都不改變,但平衡常數一定發生改變
D. 達平衡后,降低溫度或減小壓強都有利于該平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500 ℃條件下,在恒容密閉容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器內再充入1 mol NO2,下列說法正確的是
N2O4(g)。平衡后,向容器內再充入1 mol NO2,下列說法正確的是
A. 平衡向正反應方向移動 B. 平衡常數K增大
C. NO2的轉化率變小 D. 容器內氣體顏色先變深后變淺,最后比原來還要淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至過量。經測定,加入的NaOH的物質的量(mol)和所得沉淀的物質的量(mol)的關系如下圖所示。
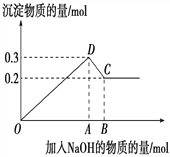
(1)寫出代表下列線段發生的反應的離子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物質的量之比為_____________。
(3)圖中B點時所加入溶液中含NaOH為________mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反應后得到3.12g沉淀。則KOH的物質的量濃度可能為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X為中學化學中一種常見的鹽,F為淡黃色固體;M、N為常見的金屬,N的氧化物可作耐火材料,可用它來制造耐火坩堝和耐高溫試驗儀器;H為氣體單質,D為無色氣體,D在空氣中會出現紅棕色,各物質的轉化關系如下圖,(部分反應產物已略去).
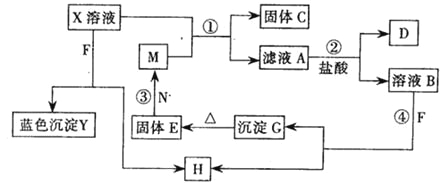
請回答下列問題;
(1)E的化學式為_____________________
(2)將M絲插入盛有X溶液的試管中,反應一段時間后的現象是:_______________________
(3)在反應①②③④中屬于置換反應的是_________________(填序號).
(4)反應②的離子方程式為___________________________________
(5)用石墨作電極電解500mL X溶液,觀察到A電極表面有紅色的固態物質生成,B電極有無色氣體生成;電解一段時間后,取出A電極,洗滌、干燥、稱量,電極增重1. 6g.請回答下列問題:
①寫出電解時的陽極反應式_______________________
②電解后溶液的pH為________________________假設電解前后溶液體積不變)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com