
【題目】利用所學知識,按以下步驟從 ![]() 合成
合成 ![]() .(部分試劑和反應條件已略去)
.(部分試劑和反應條件已略去)
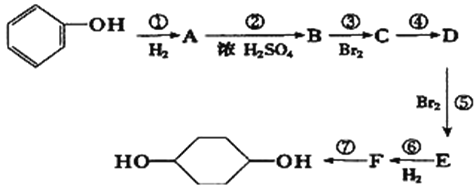
請回答下列問題:
(1)E中含有的官能團名稱為____________;D的結構簡式為________________
(2)④的反應類型為___________________。
(3)寫出反應⑦的化學方程式______________________________________。
(4)![]() 的同分異構體中,能與NaHCO3溶液反應產生氣泡的有__________種。
的同分異構體中,能與NaHCO3溶液反應產生氣泡的有__________種。
(5)寫出反應③的化學方程式______________________________
【答案】 碳碳雙鍵、溴原子 ![]() 消去反應
消去反應 ![]() 8
8 
【解析】由題中合成路線可知,苯酚經催化加氫后生成A,則A為環己醇;A與濃硫酸發生消去反應生成B,則B為環己烯;B與溴發生加成反應生成C,則C為1,2-二溴環己烷;C再發生消去反應生成D,則D為1,3-環己二烯;D與溴發生1,4-加成反應生成E;E與氫氣發生加成反應生成F,F為1,4-二溴環己烷;最后,F發生水解反應生成1,4-環己二醇。
(1)E中含有的官能團名稱為碳碳雙鍵、溴原子;D的結構簡式為![]() 。
。
(2)④的反應類型為消去反應。
(3)反應⑦的化學方程式為![]() 。
。
(4)![]() 的同分異構體中,能與NaHCO3溶液反應產生氣泡的分子中有羧基,該有機物可能有CH3CH2CH2CH2CH2COOH、CH3CH(CH3)CH2CH2COOH、CH3 CH2CH(CH3)CH2COOH、CH3 CH2CH2CH(CH3)COOH、CH3 CH2CH(CH2CH3)COOH、CH3C(CH3)2CH2COOH、CH3 CH2C(CH3)2COOH 、CH3CH(CH3)CH(CH3)COOH 等8種。
的同分異構體中,能與NaHCO3溶液反應產生氣泡的分子中有羧基,該有機物可能有CH3CH2CH2CH2CH2COOH、CH3CH(CH3)CH2CH2COOH、CH3 CH2CH(CH3)CH2COOH、CH3 CH2CH2CH(CH3)COOH、CH3 CH2CH(CH2CH3)COOH、CH3C(CH3)2CH2COOH、CH3 CH2C(CH3)2COOH 、CH3CH(CH3)CH(CH3)COOH 等8種。
(5)反應③的化學方程式為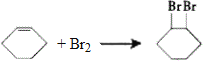 。
。


科目:高中化學 來源: 題型:
【題目】酮洛芬是一種良好的抗炎鎮痛藥,可以通過以下方法合成:

(1)化合物D中所含官能團的名稱為__________________和_____________________。
(2)化合物E的結構簡式為__________________;由B→C的反應類型是____________。
(3)寫出C→D的反應方程式____________________________________。
(4)B的同分異構體有多種,其中同時滿足下列條件的有_____種。
I.屬于芳香族化合物
II.能發生銀鏡反應
III.其核磁共振氫譜有5組波峰,且面積比為1:1:1:1:3
(5)請寫出以甲苯為原料制備化合物![]() 的合成路線流程圖____(無機試劑可任選)。合成路線流程圖示例如圖:
的合成路線流程圖____(無機試劑可任選)。合成路線流程圖示例如圖:![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,將濃度均為0.1 mol/L、體積分別為Va 和Vb 的HA溶液與BOH溶液按不同體積比混合,保持Va + Vb = 100 mL, Va、Vb與混合液的pH的關系如圖所示。下列說法不正確的是
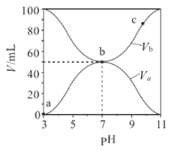
A. Ka(HA)=Kb(BOH)=10-5
B. b點時, c(B+)=c(A-)≠c(H+)=c(OH-)
C. c點時, 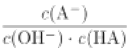 隨溫度升高不變
隨溫度升高不變
D. a→c過程中水的電離程度先增大后減小.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】發展潔凈煤技術、利用CO2制備清潔能源等都是實現減碳排放的重要途徑。
(1)將煤轉化成水煤氣的反應:C(s)+H2O(g)CO(g)+H2(g)可有效提高能源利用率,若在上述反應體系中加入催化劑(其他條件保持不變),此反應的△H______(填“增大”、“減小”或“不變”),判斷的理由是________。
(2)CO2制備甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,測得CO2(g)和CH3OH(g)濃度隨時間變化如圖所示。

① 該反應化學平衡常數K的表達式是____________________。
②0~9min時間內,該反應的平均反應速率ν(H2) =_______。
③在相同條件下,密閉容器的體積縮小至0.5 L時,此反應達平衡時放出的熱量(Q)可能是________(填字母序號)kJ。
a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98
④在一定條件下,體系中CO2的平衡轉化率(α)與L和 X的關系如圖所示,L和X分別表示溫度或壓強。

i. X表示的物理量是:_____________。
ii. 判斷L1與L2的大小關系,并簡述理由:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列陳述Ⅰ、Ⅱ正確并且有因果關系的是( )
選項 | 陳述Ⅰ | 陳述Ⅱ |
A | Fe3+有氧化性 | FeCl3溶液可用于回收廢舊電路板中的銅 |
B | SiO2有導電性 | SiO2可用于制備光導纖維 |
C | SO2有漂白性 | SO2可使溴水褪色 |
D | 濃硫酸有強氧化性 | 濃硫酸可用于干燥H2和CO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知以下的熱化學反應方程式:
Fe2O3(s)+![]() CO(g)===
CO(g)=== ![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) ΔH=-15.73 kJ/mol
CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
則42 g CO氣體還原足量FeO固體得到Fe固體和CO2氣體時對應的ΔH約為( )
A. +218 kJ/mol B. +327 kJ/mol C. -218 kJ/mol D. -327 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA是阿伏加德羅常數的值,下列說法正確的是
A. 0.1mol FeCl3水解形成的Fe(OH)3膠體粒子數為0.1 NA
B. 常溫下,78 g Na2O2中含有的陰離子數是2NA
C. 標準狀況下,11.2 L甲烷和乙烯混合物中含氫原子數目為2NA
D. pH=1的H2SO4溶液中,含有H+的數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將氣體X和氣體Y各0.16 mol充入10 L恒容密閉容器中,發生反應X(g)+Y(g) 2Z(g),ΔH<0,一段時間后達到平衡。反應過程中測定的數據如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列說法正確的是。
A. 反應前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他條件不變,降低溫度,反應達到新平衡前v(逆)>v(正)
C. 該溫度下此反應的平衡常數K=1.44
D. 其他條件不變,再充入0.3 mol Z,平衡時X的體積分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置中,U形管內為紅墨水,a、b試管內分別盛有食鹽水和氯化銨溶液(呈酸性),各加入生鐵塊,放置一段時間。下列有關描述錯誤的是( )

A. 生鐵塊中的碳是原電池的正極
B. 紅墨水柱兩邊的液面變為左低右高
C. 兩試管中相同的電極反應式是:Fe →Fe2++2e-
D. a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com