
【題目】根據題意填空
(1)常溫下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子發生電離,則溶液的pH=;可以使0.10molL﹣1 CH3COOH的電離程度增大的是
a.加入少量0.10molL﹣1的稀鹽酸 b.加熱CH3COOH溶液 c.加水稀釋至0.010molL﹣1 d.加入少量冰醋酸 e.加入少量氯化鈉固體 f.加入少量0.10molL﹣1的NaOH溶液
(2)將等質量的鋅投入等體積且pH均等于3的醋酸和鹽酸溶液中,經過充分反應后,發現只在一種溶液中有鋅粉剩余,則生成氫氣的體積:V(鹽酸)V(醋酸)(填“>”、“<”或“=”).
(3)0.1mol/L的某酸H2A的pH=4,則H2A的電離方程式為
(4)25℃時,將pH=9的NaOH溶液與pH=4的鹽酸溶液混合,若所得混合溶液的pH=6,則NaOH溶液與鹽酸溶液的體積比為 .
【答案】
(1)3;bcf
(2)<
(3)H2A?H++HA﹣ , HA﹣?H++A2﹣
(4)10:1
【解析】解:(1)0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子發生電離,溶液中氫離子濃度為0.1mol/L×1%=0.001mol/L,則溶液PH=3; a.加入少量0.10molL﹣1的稀鹽酸,溶液中氫離子濃度增大,抑制醋酸的電離,則醋酸的電離程度降低,故錯誤; b.醋酸的電離是吸熱反應,加熱CH3COOH溶液,促進醋酸的電離,則醋酸的電離程度增大,故正確; c.加水稀釋至0.010molL﹣1 , 促進醋酸的電離,則醋酸的電離程度增大,故正確; d.加入少量冰醋酸,醋酸的電離平衡向正反應方向移動,但醋酸的電離程度降低,故錯誤; e.加入少量氯化鈉固體,不影響平衡的移動,則不改變醋酸的電離,故錯誤; f.加入少量0.10molL﹣1的NaOH溶液,氫氧根離子和氫離子反應生成水,氫離子濃度降低,促進醋酸的電離,則醋酸的電離程度增大,故正確;所以答案是:3; bcf;(2)醋酸是弱酸,隨著它和金屬的反應,電離平衡不斷地向右移動,會電離出更多的氫離子,所以醋酸產生的氫氣體積較大;所以答案是:<;(3)常溫下,0.1mol/L的某酸H2A的pH=4,說明該酸部分電離,則為弱酸,H2A是二元弱酸,分步電離,電離方程式為:H2AH++HA﹣ , HA﹣H++A2﹣;所以答案是:H2AH++HA﹣ , HA﹣H++A2﹣;(4)25℃時所得混合溶液的pH=6,溶液呈酸性,則c(H+)= ![]() =10﹣6 , 所以V(HCl):V(NaOH)=10:1;所以答案是:10:1.
=10﹣6 , 所以V(HCl):V(NaOH)=10:1;所以答案是:10:1.
【考點精析】本題主要考查了弱電解質在水溶液中的電離平衡的相關知識點,需要掌握當弱電解質分子離解成離子的速率等于結合成分子的速率時,弱電解質的電離就處于電離平衡狀態;電離平衡是化學平衡的一種,同樣具有化學平衡的特征.條件改變時平衡移動的規律符合勒沙特列原理才能正確解答此題.


科目:高中化學 來源: 題型:
【題目】鎳鎘(Ni﹣Cd)可充電電池在現代生活中有廣泛應用.電解質溶液為KOH溶液,電池反應為:Cd+2NiO(OH)+2H2O ![]() Cd(OH)2+2Ni(OH)2 , 下列有關鎳鎘電池的說法正確的是( )
Cd(OH)2+2Ni(OH)2 , 下列有關鎳鎘電池的說法正確的是( )
A.充電過程是化學能轉化為電能的過程
B.充電時陽極反應為Cd(OH)2+2e﹣═Cd+2OH ﹣
C.放電時電池內部OH﹣向正極移動
D.充電時與直流電源正極相連的電極上發生Ni(OH)2轉化為NiO(OH)的反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于晶體的說法正確的是( )
A.將飽和硫酸銅溶液降溫,析出的固體不是晶體
B.假寶石往往是玻璃仿造的,可以用劃痕的方法鑒別寶石和玻璃制品
C.石蠟和玻璃都是非晶體,但它們都有固定的熔點
D.藍寶石在不同方向上的硬度一定相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NO2與N2O4相互轉化:2NO2(g)N2O4(g);△H=﹣24.2kJ/mol 在恒溫下,將一定量NO2和N2O4(g)的混合氣體充入體積為2L的密閉容器中,其中物質的濃度隨時間變化的關系如圖.下列推理分析合理的是( )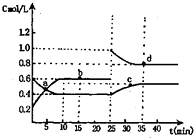
A.a,b,c,d四點中c正與v逆均相等
B.反應進行到10min時,體系吸收的熱量為9.68kJ
C.前10min內,用v(NO2)表示的該反應速率為0.02mol/Lmin
D.25min時,導致平衡移動的原因是升溫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的值.下列說法中正確的是( )
A.標準狀況下,22.4L酒精中含有的分子數目為NA
B.常溫常壓下,1.0mol/L鹽酸中含有的氯離子數目為NA
C.常溫常壓下,24gO2和24gO3含有的氧原子數目都為1.5NA
D.標準狀況下,2.24L氯氣與足量NaOH溶液反應轉移的電子數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用鐵和稀硫酸制氫氣,不能加快氫氣生成速率的措施是
A. 用等質量的鐵粉代替鐵片B. 用98%濃硫酸代替稀硫酸
C. 在稀硫酸中滴加少量CuSO4溶液D. 溶液加熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關雜化軌道的敘述錯誤的是 ( )
A.并不是所有的原子軌道都參與雜化
B.同一個原子中能量相近的原子軌道參與雜化
C.雜化軌道能量集中,有利于牢固成鍵
D.雜化軌道中一定有電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com