
【題目】四川師范大學化學與材料學院對“鐵與水蒸氣反應”實驗研究的結果顯示:在80~100℃能產生穩定水蒸氣的物質都可以作為該反應的供水劑;鐵與水蒸氣反應溫度在500℃左右即可順利進行。
某化學興趣小組同學利用該研究結論,采用西紅柿(或洋蔥)作為供水劑,設計了如圖裝置進行實驗,并對鐵與水蒸氣反應的產物進行檢驗。

回答下列問題:
(1)A中鐵與水蒸氣反應的化學方程式是_______________。
(2)C中堿石灰的作用是______________。
(3)D處實驗現象為___________________________。
(4)上述實驗結束后,取出A中鐵粉反應后的少量固體繼續進行如下實驗:

①加入稀硫酸發生的離子方程式為______________________________。
②試劑A是_____________(選填字母),現象2為___________________。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用電子天平稱取鐵粉質量為0.1527g,測得生成氫氣體積為73.50mL(實驗室條件下氣體摩爾體積為24.5L/mol).則參加反應的鐵粉占稱取鐵粉的百分數為_____(精確到0.1%)。
④有同學認為:即使得到了現象1和現象2的實驗現象,也不能確定所得固體成分為Fe3O4。你認為該同學持此看法的理由是_______________________。
【答案】 3Fe + 4H2O![]() Fe3O4 + 4H2 干燥氫氣 黑色固體變紅 Fe3O4 + 8H+
Fe3O4 + 4H2 干燥氫氣 黑色固體變紅 Fe3O4 + 8H+ ![]() Fe2+ + 2Fe3+ + 4H2O b 溶液的紫色褪去 82.5% 產物是FeO和Fe2O3的混合物也能得到現象1和現象2
Fe2+ + 2Fe3+ + 4H2O b 溶液的紫色褪去 82.5% 產物是FeO和Fe2O3的混合物也能得到現象1和現象2
【解析】(1)A中鐵與水蒸氣反應生成四氧化三鐵和氫氣,反應的化學方程式為:3Fe + 4H2O![]() Fe3O4 + 4H2;(2)C中堿石灰的作用是干燥氫氣;(3)D處高溫條件下氫氣還原氧化銅生成銅單質,實驗現象為黑色固體變紅;(4)①加入稀硫酸后四氧化三鐵與硫酸反應生成硫酸鐵、硫酸亞鐵和水,發生的離子方程式為:Fe3O4 + 8H+
Fe3O4 + 4H2;(2)C中堿石灰的作用是干燥氫氣;(3)D處高溫條件下氫氣還原氧化銅生成銅單質,實驗現象為黑色固體變紅;(4)①加入稀硫酸后四氧化三鐵與硫酸反應生成硫酸鐵、硫酸亞鐵和水,發生的離子方程式為:Fe3O4 + 8H+ ![]() Fe2+ + 2Fe3+ + 4H2O;②根據結論證明存在,說明加入試劑A為檢驗Fe2+的存在,Fe2+具有還原性,在有Fe3+存在的條件下選擇進行檢驗;故試劑A為酸性KMnO4溶液,答案選b;KMnO4被還原Fe2+,現象2為溶液的紫色褪去;③根據反應3Fe + 4H2O
Fe2+ + 2Fe3+ + 4H2O;②根據結論證明存在,說明加入試劑A為檢驗Fe2+的存在,Fe2+具有還原性,在有Fe3+存在的條件下選擇進行檢驗;故試劑A為酸性KMnO4溶液,答案選b;KMnO4被還原Fe2+,現象2為溶液的紫色褪去;③根據反應3Fe + 4H2O![]() Fe3O4 + 4H2可知,參加反應的鐵粉的質量為:
Fe3O4 + 4H2可知,參加反應的鐵粉的質量為: ![]() ,
, ![]() ;④有同學認為:即使得到了現象1和現象2的實驗現象,也不能確定所得固體成分為Fe3O4。你認為該同學持此看法的理由是產物是FeO和Fe2O3的混合物也能得到現象1和現象2。
;④有同學認為:即使得到了現象1和現象2的實驗現象,也不能確定所得固體成分為Fe3O4。你認為該同學持此看法的理由是產物是FeO和Fe2O3的混合物也能得到現象1和現象2。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】根據熱化學反應方程式:N2(g) + O2(g)→2NO(g)-180.58kJ,若在標準狀況下反應生成11.2LNO,則此過程中共
A.放出45.145kJ的熱量B.放出180.58kJ的熱量
C.吸收45.145kJ的熱量D.吸收90.29kJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁箔在酒精燈上加熱,熔化后的液態鋁滴落下來說明金屬鋁的熔點較低
B. 用如圖裝置進行實驗,將裝置①中的AlCl3滴入裝置②濃氫氧化鈉溶液中可觀察到有大量白色沉淀產生
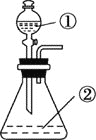
C. Al2O3和MgO均可與NaOH溶液反應
D. 在CO2中,Mg燃燒生成MgO和C在該反應條件下,Mg的還原性強于C的還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一些常見的單質、化合物之間的轉化關系圖,有些反應中的部分物質和條件被略去,A、 X、Y是常見金屬單質,其中Y既能與強酸反應,又能與強堿反應;B、C、E是常見氣體,G的焰色反應呈黃色;I的溶液呈黃色。

請回答下列問題:
(1)寫出下列物質的化學式A___、F___;
(2)說出黃綠色氣體C的一種用途___;
(3)實驗室檢驗H中所含的金屬陽離子的方法是,先加___無明顯現象,再加氯水,溶液變為___色;
(4)寫出C與H溶液反應的化學方程式___.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣可用于制取漂白劑和自來水消毒。
(1)將氯氣通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物質是 (填寫化學式)。
(2)“84”消毒液也可用于漂白,其工業制法是控制在常溫條件下,將氯氣通入NaOH溶液中,反應的離子方程式為。
(3)同學們探究“84”消毒液在不同pH下使紅紙褪色的情況,做了如下實驗:
步驟1:將5mL市售“84”消毒液稀釋100倍,測得稀釋后溶液的pH=12;
步驟2:取稀釋后溶液各20 mL分別加入3個潔凈的小燒杯中;
步驟3:用硫酸將3個燒杯內溶液的pH分別調至10、7和4。(溶液體積變化忽略不計)
步驟4:在3個燒杯中分別放入大小相同的紅紙,觀察現象,記錄如下:
燒杯 | 溶液的pH | 現象 |
a | 10 | 10 min后,紅紙基本不褪色;4h后紅紙褪色 |
b | 7 | 10 min后,紅紙顏色變淺;4 h后紅紙褪色 |
c | 4 | 10 min后,紅紙顏色變得更淺;4h后紅紙褪色 |
已知,溶液中Cl2、HC1O和ClO-物質的量分數(α) 隨pH變化的關系如下圖所示:
①由實驗現象可獲得以下結論:溶液的pH在4 ~10范圍內,pH越大,紅紙褪色。
②結合圖像進行分析,b、c兩燒杯中實驗現象出現差異的原因是。
(4)由于氯氣會與自來水中的有機物發生反應,生成對人體有害的物質,人們嘗試研究并使用新的自來水消毒劑,如ClO2氣體就是一種新型高效含氯消毒劑。
①一種制備ClO2的方法是將SO2通入硫酸酸化的NaClO3溶液中,反應的離子方程式為。
②另一種制備ClO2的方法是用NaClO3與鹽酸反應,同時有Cl2生成,產物中Cl2體積約占1/3。則每生成0.5 mol ClO2 , 轉移mole-。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com