
(1)Zn粒和稀鹽酸反應一段時間后,反應速率會減慢,當加熱或加入濃鹽酸后,反應速率明顯加快。由此判斷,影響化學反應速率的因素有 和 。
(2)為探究鋅與鹽酸反應過程的速率變化,某同學的實驗測定方法是:在100ml稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(氫氣體積已換算為標準狀況):
| 時間/min | 1 | 2 | 3 | 4 | 5 |
| 體積/mL | 50 | 120 | 232 | 290 | 310 |
(8分)(1)溫度 (1分) 濃度 (1分)(2)①2~3min反應速率最大(2分)
②0.1mol.L-1.min-1 (2分) ③反應放熱成為影響速率的主要因素。(2分)
解析試題分析:(1)Zn粒和稀鹽酸反應一段時間后,反應速率會減慢,當加熱或加入濃鹽酸后,反應速率明顯加快。由此判斷,影響化學反應速率的因素有溫度和濃度。
(2)①根據表中數據可知0~1 min、1~2 min、2~3 min、3~4 min、4~5min內生成氫氣的體積(ml)分別是50、70、112、58、20,所以2~3min反應速率最大。
②2~3 min時間段內刪除氫氣的物質的量是0.112L÷22.4/mol=0.005mol,所以消耗鹽酸的物質的量是0.01mol,其濃度是0.01mol÷0.1L=0.1mol/L,因此以鹽酸的濃度變化來表示的該反應速率0.1mol/L÷1min=0.1mol.L-1.min-1。
③因為反應放熱,隨著反應的進行,溶液的溫度越來越高,溫度成為影響速率的主要因素。
考點:考查外界條件對反應速率的影響、反應速率的計算等
點評:該題是基礎性試題的考查,難度不大。明確反應速率的含義、計算依據以及影響反應速率的因素是答題的關鍵,有利于培養學生的邏輯思維能力和發散思維能力,有助于提升學生的學科素養。


科目:高中化學 來源: 題型:計算題
碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用。
(1)真空碳熱還原—氯化法可實現由鋁礦制備金屬鋁,其相關的熱化學方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反應Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代數式表示);
(2)用活性炭還原法可以處理氮氧化物。某研究小組向某密閉容器中加入一定量的活性炭和NO,發生反應C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃時,反應進行到不同時間測得各物質的濃度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃時,反應進行到不同時間測得各物質的濃度如下:
| 時間(min) 濃度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某酸性工業廢水中含有K2Cr2O7。光照下,草酸(H2C2O4)能將其中的Cr2O72—轉化為Cr3+。某課題組研究發現,少量鐵明礬[Al2Fe(SO4)4·24H2O]即可對該反應起催化作用。為進一步研究有關因素對該反應速率的影響,探究如下:
(1)在25 ℃下,控制光照強度、廢水樣品初始濃度和催化劑用量相同,調節不同的初始pH和一定濃度草酸溶液用量,做對比實驗,完成以下實驗設計表(表中不要留空格)。
| 實驗編號 | 初始pH | 廢水樣品體積/mL | 草酸溶液體積/mL | 蒸餾水體積/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | | |
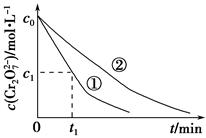
| 實驗方案(不要求寫具體操作過程) | 預期實驗結果和結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某探究小組用測量HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。限選試劑:1.00 mol·L-1 HNO3、2.00 mol·L-1 HNO3,細顆粒大理石、粗顆粒大理石,35 ℃水浴。
(1)他們能完成哪些因素對速率影響的探究?
____________________________________________________________。
(2)請根據能進行的探究內容,填寫以下實驗設計表,完成探究實驗:
(3)整個實驗中應控制的不變量是硝酸溶液體積和 。
(4)該實驗小組用如圖實驗裝置進行實驗。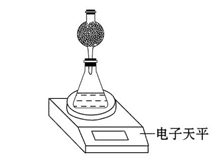
①除電子天平、干燥管、錐形瓶、藥匙、膠塞等儀器外,必需的實驗儀器還有 。
②干燥管中應放置的試劑是 。
| A.堿石灰 | B.無水CaCl2 |
| C.P2O5固體 | D.濃硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某實驗小組為確定過氧化氫分解的最佳催化條件,用如圖實驗裝置進行實驗,反應物用量和反應停止的時間數據如下: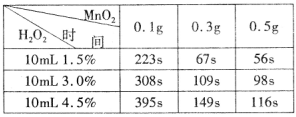
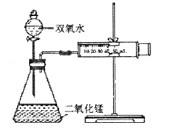
分析表中數據回答下列問題,
(1)相同濃度的過氧化氫的分解速率隨著二氧化錳用量的增加而____________。
(2)從實驗效果和“綠色化學”的角度考慮,雙氧水的濃度相同時,加入_____g的二氧化錳為較佳選擇。
(3)該小組的某同學分析上述數據后認為:“當用相同質量的二氧化錳時,雙氧水的濃度越小,所需要的時間就越少,亦即其反應速率越快”的結論,你認為是否正確_______理由是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
甲酸甲酯水解反應方程式為:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
某小組通過實驗研究該反應(反應過程中體積變化忽略不計)。反應體系中各組分的起始量如下表。甲酸甲酯轉化率在溫度T1下隨反應時間(t)的變化如下圖:
| 組分 | 物質的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某學習小組利用鐵與稀硫酸的反應,進行“探究影響化學反應速率因素”的實驗。結果如下表:
| 實驗 序號 | 鐵的質量/g | 鐵的 形態 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反應前溶液 的溫度/℃ | 金屬完全消 失的時間/s |
| 1 | 0.10 | 片狀 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉狀 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片狀 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片狀 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在0.1mol/L的CH3COOH溶液中存在如下電離平衡:CH3COOH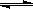 CH3COO-+H+ 對于該平衡,下列敘述正確的是
CH3COO-+H+ 對于該平衡,下列敘述正確的是
| A.加入少量NaOH固體,平衡向逆反應方向移動 |
| B.升高溫度,平衡向正反應方向移動 |
| C.加入水稀釋,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固體,平衡向正反應方向移動 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com