
【題目】下列實驗操作、現象與結論均正確的是
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 25℃,兩片相同的Al片分別和等體積的稀HNO3和濃HNO3反應 | 前者產生無色氣體,后者產生紅棕色氣體,且后者反應更加劇烈 | 其他條件相同時,反應物濃度越大,反應速率越快 |
B | 往黃色固體難溶物PbI2中加水,振蕩,靜置。取上層清液,然后加入NaI固體 | 產生黃色沉淀 | 難溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白質溶液中分別加入乙醇溶液和(NH4)2SO4飽和溶液 | 均產生白色沉淀 | 蛋白質均發生了變性 |
D | 向稀硫酸中加入銅片,然后通入氧氣加熱 | 開始無明顯現象,通入氧氣加熱后溶液變藍 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
【答案】B
【解析】分析:A項,常溫下Al與濃HNO3發生鈍化;B項,c(I-)增大,溶解平衡逆向移動;C項,蛋白質溶液中加入飽和(NH4)2SO4溶液產生白色沉淀,蛋白質發生鹽析;D項,發生的反應為2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
詳解:A項,常溫下Al與濃HNO3發生鈍化,A項錯誤;B項,在PbI2的飽和溶液中加入NaI固體產生黃色沉淀,說明c(I-)增大,飽和PbI2溶液中的沉淀溶解平衡逆向移動,析出PbI2固體,B項正確;C項,蛋白質溶液中加入乙醇溶液產生白色沉淀,蛋白質發生變性,蛋白質溶液中加入飽和(NH4)2SO4溶液產生白色沉淀,蛋白質發生鹽析,C項錯誤;D項,在金屬活動性順序表中,Cu處于H的后面,Cu與稀硫酸不反應,通入O2后加熱溶液變藍,發生反應2Cu+O2+2H2SO4![]() 2CuSO4+2H2O,在該反應中Cu為還原劑,O2為氧化劑,根據同一反應中氧化性:氧化劑
2CuSO4+2H2O,在該反應中Cu為還原劑,O2為氧化劑,根據同一反應中氧化性:氧化劑![]() 氧化產物,得出氧化性:O2
氧化產物,得出氧化性:O2![]() Cu2+,D項錯誤;答案選B。
Cu2+,D項錯誤;答案選B。


科目:高中化學 來源: 題型:
【題目】回答下列問題。
(1)CS2是一種常用的溶劑,CS2的分子中存在________個σ鍵。在H—S、H—Cl兩種共價鍵中,鍵的極性較強的是________,鍵長較長的是________。
(2)氫的氧化物與碳的氧化物中,分子極性較小的是________(填分子式)。
(3)SO2與CO2分子的立體結構分別是________和________,相同條件下兩者在水中的溶解度較大的是______(寫分子式),理由是____________________________。
(4)醋酸的球棍模型如圖1所示。
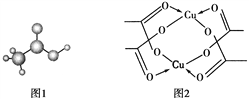
①在醋酸中,碳原子的軌道雜化類型有________;
②Cu的水合醋酸鹽晶體局部結構如圖2所示,該晶體中含有的化學鍵是________(填選項字母)。
A.極性鍵 B.非極性鍵 C.配位鍵 D.金屬鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向10mL 0.1mol·L1NH4Al(SO4)2溶液中,滴加等濃度Ba(OH)2溶液x mL,下列敘述正確的是
A.x=10時,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-) >c(Al3+)
B.x=15時,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-)
C.x=20時,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+)
D.x=30時,溶液中有Ba2+、AlO2-、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某實驗小組對H2O2的分解做了如下探究。下表是該實驗小組研究影響H2O2分解速率的因素時記錄的一組數據,將質量相同但狀態不同的MnO2分別加入盛有15 ml 5%的H2O2溶液的大試管中,并用帶火星的木條測試,結果如下:
MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5 min |
塊狀 | 微熱 | 反應較慢,火星紅亮但木條未復燃 | 30 min |
(1)寫出大試管中發生反應的化學方程式:_________________,該反應是______反應(填放熱[或吸熱)。
(2)實驗結果表明,催化劑的催化效果與_____________________________有關。
Ⅱ.某可逆反應在某體積為5L的密閉容器中進行,在從0—3分鐘各物質的量的變化情況如圖所示(A,B,C均為氣體)。
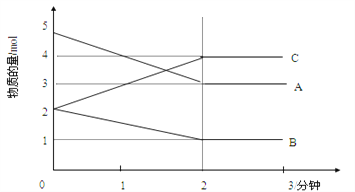
(3)該反應的的化學方程式為_____________________________________________;
(4)反應開始至2分鐘時,B的平均反應速率為_____________________________。
(5)能說明該反應已達到平衡狀態的是________________________。
a.v(A)= 2v(B)
b.容器內壓強保持不變
c.2v逆(A)= v正(B)
d.容器內混合氣體的密度保持不變
(6)在密閉容器里,通入a mol A (g)、b mol B (g)、c molC(g),發生上述反應,
當改變下列條件時,反應速率會減小的是____。
A.降低溫度B.加入催化劑(正)C.增大容器體積
Ⅲ.(7)為了減緩過量Zn與鹽酸產生氫氣的反應速率而又不減少產生氫氣的量,在鹽酸中分別加入下列物質:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你認為可行的是(填編號)________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《本草圖經》中關于綠礬的分解有如下描述:“綠礬形似樸消(Na2SO4·10H2O)而綠色,取此物置于鐵板上,聚炭,封之囊袋,吹令火熾,其礬即沸,流出,色赤如融金汁者是真也。”對此段話的說明中肯定錯誤的是( )
A. 綠礬的化學式為FeSO4·7H2O B. 綠礬分解過程中沒有發生電子的轉移
C. “色赤”物質可能是Fe2O3 D. 流出的液體中可能含有硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密閉容器中反應,達到平衡狀態的標志是( )
2NO(g)+O2(g)在一恒容的密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n mol O2的同時生成2n mol NO2 ②單位時間內生成n mol O2的同時生成2n mol NO ③用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2∶2∶1的狀態 ④混合氣體的顏色不再改變的狀態 ⑤混合氣體的密度不再改變的狀態 ⑥混合氣體的平均相對分子質量不再改變的狀態 ⑦混合氣體的壓強不再改變的狀態
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO、NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)與氮氧化物有關的全球或區域性大氣環境問題有_______(填字母序號)。
a.酸雨 b.沙塵暴 c.光化學煙霧 d.白色污染
(2)NO2可與水發生反應,反應的化學方程式為__________________。若該反應有0.6NA個電子轉移,則參加反應的NO2的物質的量為___________。
(3)NH3也是重要的含氮化合物,請寫出實驗室中由固體物質制取氨氣的化學方程式________________________________;工業上可利用NH3經過一系列反應制取硝酸,請寫出NH3在催化劑的作用下,與O2反應的化學方程式_________________________________。
(4)硝酸可與不活潑金屬銅發生反應。將過量的銅置入一定量的濃硝酸中,微熱,充分反應后,放出1.12 L氣體(標準狀況下),
①寫出反應過程其中1個化學反應的化學方程式:_______________________________。
②整個反應過程中,被還原的HNO3總的物質的量是___________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時,鹵化銀(AgX,X=Cl,Br)的2條溶解平衡曲線如圖所示,已知AgCl,AgBr的Ksp依次減小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐標系可表示出AgX的溶度積與溶液中的c(Ag+)和c(X-)的相互關系.下列說法錯誤的是
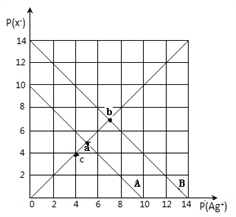
A. t℃時,c點可表示AgCl的不飽和溶液
B. B線表示的是AgBr
C. 取a、b兩點處溶液等體積混合,維持t℃不變,混合溶液中一定無白色沉淀生成
D. 在t℃時,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常數K≈104
AgBr(s)+Cl-(aq)平衡常數K≈104
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 0.1mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B. Na2CO3溶液加水稀釋后,恢復至原溫度,pH和Kw均減小
C. 在Na2S溶液中加入AgC1固體,溶液中c(S2-)下降
D. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com