
【題目】五種短周期元素的部分性質數據如下:
元素 | T | X | Y | Z | W |
原子半徑(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合價 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
請回答下列問題:
(1)Z離子的結構示意圖為________________。
(2)關于Y、Z兩種元素,下列敘述正確的是________(填序號)
a.簡單離子的半徑Y>Z
b.氣態氫化物的穩定性Y比Z強
c.最高價氧化物對應水化物的酸性Z比Y強
(3)甲是由T、X兩種元素形成的10e-分子,乙是由Y、W兩種元素形成的化合物。
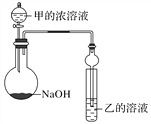
某同學設計了如圖所示裝置(夾持儀器省略)進行實驗,將甲的濃溶液逐滴加入到NaOH固體中,燒瓶中立即有甲放出,原因是______________________。
一段時間后,觀察到試管中的現象是______________________________,發生反應的離子方程式是______________________________________________。
(4)XO2是導致光化學煙霧的“罪魁禍首”之一。它被NaOH溶液吸收的化學方程式是:2XO2+2NaOH===M+NaXO3+H2O(已配平),產物M中元素X的化合價為____________________。
【答案】  b 把濃氨水滴到NaOH固體上,NaOH固體可吸收水,并且溶液中OH-濃度增大,可使平衡NH3+H2O
b 把濃氨水滴到NaOH固體上,NaOH固體可吸收水,并且溶液中OH-濃度增大,可使平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-向左移動,且過程中放熱,故有利于NH3放出 生成白色沉淀 Al3++3NH3·H2O===Al(OH)3↓+3NH
+OH-向左移動,且過程中放熱,故有利于NH3放出 生成白色沉淀 Al3++3NH3·H2O===Al(OH)3↓+3NH![]() +3
+3
【解析】試題分析:(1)由Z為短周期元素,其化合價為+6、-2,則Z為硫;
(2)由Y的化合價及Y為短周期元素,則Y為Cl;
(3)由表中的化合價及元素都在短周期,T、X兩種元素形成的10e-分子,T為H元素,W為Al元素,則甲為氨氣,乙為氯化鋁;
(4)由X的化合價可知X為第ⅤA族元素,XO2是導致光化學煙霧的“罪魁禍首”之一,則X為N元素。
解析:(1)由Z為短周期元素,其化合價為+6、-2,則Z為硫,其質子數為16,硫離子帶2個單位的負電荷,則最外層電子數為8,S2-的結構示意圖為![]() ;
;
(2)由Y的化合價及Y為短周期元素,則Y為Cl,氯離子半徑小于硫離子半徑,則a錯;氯比硫元素的非金屬性強,則HCl的穩定性強于H2S,則b對;
氯比硫元素的非金屬性強,則高氯酸的酸性大于硫酸的酸性,則C錯誤;
(3)由表中的化合價及元素都在短周期,T、X兩種元素形成的10e-分子,T為H元素,W為Al元素,則甲為氨氣,乙為氯化鋁,由圖可知,燒瓶中發生氨水與氫氧化鈉的反應制取氨氣,試管中發生氯化鋁與氨水的反應生成沉淀,制取氨氣的原理為NH3+H2O![]() NH3
NH3![]() H2O
H2O![]() NH4++OH-,NaOH溶于水電離出OH-,使平衡向左移動,且溶解時放出熱量,使NH3的溶解度減小,試管中的反應為Al3++3NH3H2O=Al(OH)3↓+3NH4+;
NH4++OH-,NaOH溶于水電離出OH-,使平衡向左移動,且溶解時放出熱量,使NH3的溶解度減小,試管中的反應為Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)由X的化合價可知X為第ⅤA族元素,XO2是導致光化學煙霧的“罪魁禍首”之一,則X為N元素,再由2XO2+2NaOH=M+NaXO3+H2O可知,NO2中N元素的化合價+4價,NaNO3中N元素的化合價為+5價,由氧化還原反應中得失電子守恒可知M中N的化合價為+3價。


科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種物質的轉化關系如圖所示。下列組合中不符合該關系的是( )
A | B | C | D | |
X | HCl | Na2O2 | Na2CO3 | SO2 |
Y | FeCl2 | NaOH | CO2 | Na2SO3 |
Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有三組實驗:① 分離花生油和水;② 分離乙二醇和丙三醇 已知乙二醇(C2H6O2)是無色液體,易溶于水和乙醇,沸點197.3℃。丙三醇(C3H8O3)是無色液體,易溶于水和乙醇,沸點259℃ ];③ 用食用酒精浸泡中草藥提取其中的有效成份。正確方法依次是( )
A. 分液、蒸餾、分液 B. 分液、蒸餾、萃取
C. 蒸餾、蒸餾、萃取 D. 蒸餾、分液、萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質用途的敘述中,錯誤的是
A. 水玻璃是制取水泥的原料
B. 二氧化硅是制造光導纖維的材料
C. 硅是制造太陽能電池的常用材料
D. 纖維常用做復合材料的增強體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 物質的量相同的氣體單質具有相同的原子數 B. 鎂原子的質量就是鎂的相對原子質量
C. 水的相對分子質量等于18g·mol-1 D. 1mol鐵原子的質量約為56g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中的實線表示元素周期表的部分邊界。①~⑤分別表示元素周期表中對應位置的元素。

(1)元素③④⑤的氫化物的穩定性由強到弱的順序是____________________ (用氫化物的化學式表示)。
(2)元素③一般在化合物中顯________價,但在與______形成化合物時,所顯示的價態正好相反。
(3)M、N兩種化合物均由①②③④四種元素組成,寫出此兩種化合物在水溶液中發生反應的離子方程式:____________________________________。
(4)X、Y、Z代表原子序數依次增大的三種短周期元素。在周期表中,Y與X相鄰,Y與Z也相鄰;X、Y和Z三種元素原子的最外層電子數之和為17;X、Y、Z三種元素有的是上表中編號①~⑤的元素,有的不是,請在上表中用元素符號標出不是①~⑤元素的相應位置。___________
(5)某同學受鑭系、錒系元素排列方式的啟發,將元素周期表設計成下列更簡明的形式,把118種元素全部排列在內,表中除A、B、C、D外每個位置只表示一種元素。則該表中的A位置包含________(填數字)種元素。C位置中的元素是否全部是金屬元素________(填“是”或“否”)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家對一碳化學進行了廣泛深入的研究并取得了一些重要成果。
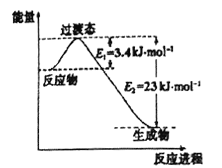
(1)目前工業上有一種方法是用CO2和H2在230℃催化劑條件下轉化生成甲醇蒸汽和水蒸氣。下圖表示恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖。寫出該反應的熱化學方程式:__________________。
(2)現向三個體積均為2L的恒容密閉容器Ⅰ、Ⅱ、Ⅲ中均分別充入lmolCO和2molH2發生反應:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三個容器的反應溫度分別為T1、T2、T3且恒定不變,當反應均進行到5min時H2的體積分數如圖所示,其中只有一個容器中的反應己經達到平衡狀態.
CH3OH(g) △H1=-90.1kJ/mol。三個容器的反應溫度分別為T1、T2、T3且恒定不變,當反應均進行到5min時H2的體積分數如圖所示,其中只有一個容器中的反應己經達到平衡狀態.

① 三個容器中一定達到平衡狀態的是容器_____(填序號,下同)
②0~5min時間內容器I中用CH3OH表示的化學反應速率為__________。
③ 當三個容器中的反應均達到平衡狀態時CO 的轉化率最高的是容器_____;平衡常數最小的是容器______。
(3)CO常用于工業冶煉金屬.右下圖是在不同溫度下CO還原四種金屬氧化物達平衡后氣體中lg[![]() ]與溫度(t)的關系曲線圖。下列說法正確的是_______。
]與溫度(t)的關系曲線圖。下列說法正確的是_______。
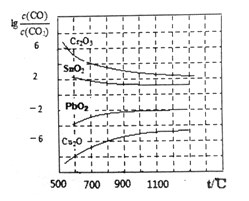
A.工業上可以通過增高反應裝置來延長礦石和CO接觸的時間,減少尾氣中CO的含量
B.CO不適宜用于工業冶煉金屬鉻(Cr)
C.工業冶煉金屬銅(Cu)時較低的溫度有利于提高CO的利用率
D.CO還原PbO2的反應△H>O
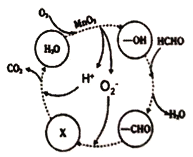
(4)某工廠工業廢水中含有甲醛,該廠降解甲醛的反應機理如圖所示,則X表示的粒子是____,總反應的化學方程式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】針對實驗室制取氨氣,下列說法不正確的是
A. 發生裝置與用KClO3制取O2的裝置相同
B. 可用濃硫酸干燥氨氣
C. 可用向下排空氣法收集氨氣
D. 氨氣的驗滿可以用蘸有濃鹽酸的玻璃棒放于試管口附近
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中含有CO32-、SO42-、 NH4+和M離子的物質的量之比為1:2:4:2,則離子M可能是
A. H+![]() B. K+
B. K+![]() C. C1- D. Ba2+
C. C1- D. Ba2+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com