
【題目】研究NO2、SO2 . CO等大氣污染氣體的處理具有重要意義.
(1)NO2可用水吸收,相應的化學反應方程式為
利用反應6NO2+8NH3 ![]() 7N2+12H2O也可處理NO2 . 當轉移1.2mol電子時,消耗的NO2在標準狀況下是 L.
7N2+12H2O也可處理NO2 . 當轉移1.2mol電子時,消耗的NO2在標準狀況下是 L.
(2)已知:2SO2(g)+O2(g)![]()
![]() 2SO3(g)△H=﹣196.6kJmol﹣1
2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
則反應SO2(g)+NO2(g)=SO3(g)+NO(g)的△H=kJmol﹣1
一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發(fā)生上述反應,下列能說明反應達到平衡狀態(tài)的是
A.體系壓強保持不變 B.混合氣體顏色保持不變
C.SO2和NO的體積比保持不變 D.每消耗1molSO3的同時生成1mol NO2
測得上述反應平衡時NO2與SO2體積比為1:6,則平衡常數K=
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)CH3OH(g).CO在不同溫度下的平衡轉化率與壓強的關系如圖所示.該反應△H0(填“>”或“<”)實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是 . 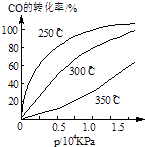
【答案】
(1)3NO2+H2O=2HNO3+NO;6.72
(2)﹣41.8;B;![]()
(3)<;在1.3×104kPa下,CO的轉化率已較高,再增大壓強CO的轉化率提高不大,而生產成本增加得不償失
【解析】解:(1)二氧化氮和水反應生成硝酸和一氧化氮,反應的化學方程式為:3NO2+H2O=2HNO3+NO,反應6NO2+8NH3![]() 7N2+12H2O中,6NO2中N元素化合價降低,由+4價降低到0價,則6molNO2參加反應,轉移24mol電子,所以當轉移1.2mol電子時,消耗NO20.3mol,體積為6.72L,所以答案是:3NO2+H2O=2HNO3+NO,6.72;(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1②2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1 , 利用蓋斯定律將①×
7N2+12H2O中,6NO2中N元素化合價降低,由+4價降低到0價,則6molNO2參加反應,轉移24mol電子,所以當轉移1.2mol電子時,消耗NO20.3mol,體積為6.72L,所以答案是:3NO2+H2O=2HNO3+NO,6.72;(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1②2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1 , 利用蓋斯定律將①× ![]() ﹣②×
﹣②× ![]() 得NO2(g)+SO2(g)SO3(g)+NO(g)△H=
得NO2(g)+SO2(g)SO3(g)+NO(g)△H= ![]() ×(﹣196.6kJmol﹣1)﹣
×(﹣196.6kJmol﹣1)﹣ ![]() ×(﹣113.0kJmol﹣1)=﹣41.8kJmol﹣1 , A.無論是否達到平衡,體系壓強都保持不變,不能用于判斷是否達到平衡狀態(tài),故A錯誤; B.混合氣體顏色保持不變,說明濃度不變,達到平衡狀態(tài),故B正確; C.SO3和NO的計量數之比為1:1,無論是否達到平衡,二者的體積比保持不變,不能判斷是否達到平衡狀態(tài),故C錯誤;
×(﹣113.0kJmol﹣1)=﹣41.8kJmol﹣1 , A.無論是否達到平衡,體系壓強都保持不變,不能用于判斷是否達到平衡狀態(tài),故A錯誤; B.混合氣體顏色保持不變,說明濃度不變,達到平衡狀態(tài),故B正確; C.SO3和NO的計量數之比為1:1,無論是否達到平衡,二者的體積比保持不變,不能判斷是否達到平衡狀態(tài),故C錯誤;
D.物質的量之比等于化學計量數之比,則每消耗1mol SO3的同時生成1molNO2 , 不能判斷是否達到平衡狀態(tài),故D錯誤.
NO2(g)+SO2(g)SO3(g)+NO(g)
起始物質的體積 a 2a 0 0
轉化物質的體積 x x x x
平衡物質的體積 a﹣x 2a﹣x x x
平衡時NO2與SO2體積比為1:6,即(1a﹣x):(2a﹣x)=1:6,故x= ![]() a,故平衡常數K=
a,故平衡常數K= ![]() =
= ![]() =
= ![]() =
= ![]() ,所以答案是:﹣41.8;B;
,所以答案是:﹣41.8;B; ![]() ;(3)由圖可知,溫度升高,CO的轉化率降低,平衡向逆反應方向移動,故逆反應是吸熱反應,正反應是放熱反應,△H<0;壓強大,有利于加快反應速率,有利于使平衡正向移動,但壓強過大,需要的動力大,對設備的要求也高,故選擇250℃、1.3×104kPa左右的條件.因為在250℃、壓強為1.3×104 kPa時,CO的轉化率已較大,再增大壓強,CO的轉化率變化不大,沒有必要再增大壓強.所以答案是:<,在1.3×104kPa下,CO的轉化率已較高,再增大壓強CO的轉化率提高不大,而生產成本增加得不償失.
;(3)由圖可知,溫度升高,CO的轉化率降低,平衡向逆反應方向移動,故逆反應是吸熱反應,正反應是放熱反應,△H<0;壓強大,有利于加快反應速率,有利于使平衡正向移動,但壓強過大,需要的動力大,對設備的要求也高,故選擇250℃、1.3×104kPa左右的條件.因為在250℃、壓強為1.3×104 kPa時,CO的轉化率已較大,再增大壓強,CO的轉化率變化不大,沒有必要再增大壓強.所以答案是:<,在1.3×104kPa下,CO的轉化率已較高,再增大壓強CO的轉化率提高不大,而生產成本增加得不償失.
【考點精析】解答此題的關鍵在于理解反應熱和焓變的相關知識,掌握在化學反應中放出或吸收的熱量,通常叫反應熱,以及對化學平衡的計算的理解,了解反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


 名校聯盟快樂課堂系列答案
名校聯盟快樂課堂系列答案 黃岡創(chuàng)優(yōu)卷系列答案
黃岡創(chuàng)優(yōu)卷系列答案科目:高中化學 來源: 題型:
【題目】2020年的新型冠狀病毒中,口罩和醫(yī)用酒精在防疫工作中起到重要作用,醫(yī)用口罩由三層無紡布制成,無紡布的主要原料是聚丙烯樹脂。下列說法正確的是( )
A.84消毒液、二氧化氯泡騰片可作環(huán)境消毒劑
B.聚丙烯樹脂屬于合成無機高分子材料
C.醫(yī)用酒精中乙醇的體積分數為 95%
D.抗病毒疫苗冷藏存放的目的是避免蛋白質鹽析
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.非極性分子只能是雙原子單質分子
B.鍵能越大,表示該分子越容易受熱分解
C.液態(tài)氟化氫中氟化氫分子之間存在氫鍵
D.分子中中心原子通過 sp3 雜化軌道成鍵時,該分子一定為正四面體結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列溶液中,能大量共存的一組離子是( )
A.pH=1的溶液中:NH4+、Fe2+、SO ![]() 、Cl﹣
、Cl﹣
B.通入過量SO2氣體的溶液中:Fe3+、NO3﹣、Ba2+、H+
C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO ![]() 、SO
、SO ![]()
D.由水電離出的c(H+)=1×10﹣13 mol/L的溶液中:Na+、HCO ![]() 、Cl﹣、Br﹣
、Cl﹣、Br﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相對位置如圖(甲不一定在丁、庚的連線上),戊、己分別是空氣、地殼中含量最多的元素。下列判斷錯誤的是 ( )
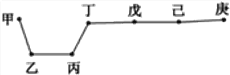
A. 甲可能是金屬元素
B. 氣態(tài)氫化物的穩(wěn)定性:庚>己>戊
C. 丙與戊的最高價氧化物的水化物可以相互反應
D. 庚的最高價氧化物的水化物酸性最強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學與技術]水處理技術在生產、生活中應用廣泛.
(1)含有較多離子的水稱為硬水.硬水加熱后產生碳酸鹽沉淀的離子方程式為(寫出一個即可)
(2)將RH型陽離子交換樹脂和ROH型陰離子交換樹脂串接來軟化天然硬水,應首先使硬水通過(填“RH”或“ROH”)型離子交換樹脂,原因是 .
(3)通過施加一定壓力使水分子通過半透膜而將大分子或離子截留,從而獲得純凈水的方法稱為 . 電滲析法凈化水時,使離子通過半透膜的推動力是 .
(4)檢驗蒸餾水的純度時,最簡單易行的方法是測定水的 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某密閉容器中,有A.B兩種氣體,反應按下式進行A(g)+B(g)═2C(g)反應經過2S后濃度不再發(fā)生變化時,測得容器中各物質的濃度分別為c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L.
(1)B物質的起始濃度為
(2)2S時A的轉化率
(3)用物質A表示反應的平均速率 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去下列物質中的雜質(括號中為雜質),采用的試劑和除雜方法錯誤的是( )
選項 | 含雜質的物質 | 試劑 | 除雜方法 |
A | C2H4(SO2) | NaOH溶液 | 洗氣 |
B | C6H6(苯酚) | 濃Br2水 | 過濾 |
C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
D | C2H2(H2S) | CuSO4溶液 | 洗氣 |
A.A
B.B
C.C
D.D
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com