
合理使用材料,改善人類生活。
① 鋼鐵是人類生產和生活中非常重要的材料,但每年因銹蝕而損失的數量十分驚人。金屬腐蝕分為化學腐蝕和電化學腐蝕,兩者的微觀本質都是發生 的過程。為防止輪船船體在海水中被腐蝕,一般在船身連接 (選填“鋅塊”或“銅塊”)。
② 在普通玻璃制造過程中,碳酸鈣與二氧化硅在高溫下發生反應的化學方程式是
。橡膠是制造輪胎的重要原料,天然橡膠通過硫化措施,使它的分子轉化為 結構,從而增大橡膠的強度。
科目:高中化學 來源: 題型:填空題
如下圖所示的裝置中,若通入直流電5 min時,銅電極質量增加2.16 g,試回答:
(1)電源電極X的名稱為________。
(2)pH變化:A________,B________,C________。(填“增大”“減小”或“不變”)
(3)通電5 min后,B中共收集224 mL氣體(標準狀況),溶液體積為200 mL,則通電前CuSO4溶液的物質的量濃度為________(設電解前后溶液體積無變化)。
(4)若A中KCl溶液的體積也是200 mL,電解后,溶液中OH-的物質的量濃度為________(設電解前后溶液體積無變化)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
如下圖所示,某同學設計了一個燃料電池并探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。請按要求回答相關問題:
(1)甲烷燃料電池負極電極反應式是:
(2)石墨電極(C)的電極反應式為
(3)若在標準狀況下,有2. 24 L氧氣參加反應,則乙裝置中鐵電極上生成的氣體體積為_ L;丙裝置中陰極析出銅的質量為 g
(4)某同學利甲烷燃料電池設計電解法制取漂白液或Fe(OH)2的實驗裝置(如圖所示)。若用于制漂白液時a為電池_ 極,電解質溶液最好用_ 。若用于制 Fe(OH)2,使用硫酸鈉做電解質溶液,陽極選用 作電極。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
電解原理在化學工業中有廣泛應用。下圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。
請回答以下問題:
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則
①電解池中X極上的電極反應式為 。
在X極附近觀察到的現象是 。
②Y電極上的電極反應式為 ,
檢驗該電極反應產物的方法是 。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是 ,電極反應式是 。
②Y電極的材料是 ,電極反應式是 。
(說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(13分)
海水是巨大的化學資源寶庫。
Ⅰ.從海水中可以提取氯、溴、碘等鹵族元素。
(1)Cl2的電子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下圖表示平衡常數K與溫度t的關系。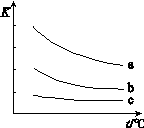
①ΔH 表示X2與H2反應的焓變,ΔH 0。(填“>”、“<”或“=”)
② 曲線a表示的是 (填“Cl2”、“Br2”或“I2”)與H2反應時K與t的關系。
Ⅱ.海水淡化具有廣泛的應用前景,淡化前需對海水進行預處理。
(1)通常用明礬[K2SO4·Al2(SO4)3·24H2O]作混凝劑,降低濁度。明礬水解的離子方程式是 。
(2)用下圖所示NaClO的發生裝置對海水進行消毒和滅藻處理。
① 裝置中由NaCl轉化為NaClO的化學方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等雜質離子,處理過程中裝置的陰極易產生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的離子方程式是 。
③ 若每隔5-10 min倒換一次電極電性,可有效地解決陰極的結垢問題。
試用電極反應式并結合必要的文字進行解釋 。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)2013年初,霧霾天氣多次肆虐天津、北京等地區。其中,燃煤和汽車尾氣是
造成空氣污染的原因之一。
(l)汽車尾氣凈化的主要原理為:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①該反應平衡常數表達式____________________________
②若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是________________(填代號)。
(2)直接排放煤燃燒產生的煙氣會引起嚴重的環境問題。煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)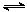 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
寫出CH4催化還原N2O4(g)生成N2和H2O(1)的熱化學方程式:_____________________。
(3)甲烷燃料電池可以提升能量利用率。下圖是利用甲烷燃料電池電解100mLlmol/L食鹽水,電解一段時間后,收集到標準狀況下的氫氣2.24L(設電解后溶液體積不變).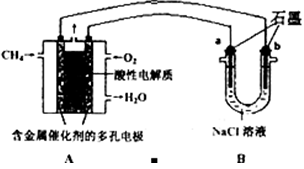
①甲烷燃料電池的負極反應式:______________________________________.
②電解后溶液的pH=____(忽略氯氣與氫氧化鈉溶液反應)
③陽極產生氣體的體積在標準狀況下是________L
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(8分)請用相關知識回答下列問題:
(1)用純凈的碳酸鈣與稀鹽酸反應制取二氧化碳氣體,實驗過程測得的CO2氣體體積隨時間變化如右圖所示。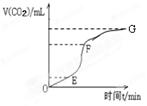
①________段化學反應速率最快,_______段收集的二氧化碳氣體最多。
②除加入蒸餾水外,當加入下列物質中的 (填序號)時,則能夠減緩上述反應的速率。
A.醋酸鈉溶液 B.碳酸鈣粉末 C.稀硫酸 D.濃鹽酸
(2)原電池是一種能量裝置。
①下列在理論上可用來設計原電池的反應是 (填序號)。
A.NaOH +HCl==NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4 D.C2H6O +3O2==3H2O+2CO2
②實驗室中用鋅片與硫酸反應制取氫氣時,向反應溶液中滴加幾滴CuSO4溶液,可以發現產生氫氣速率明顯加快,其原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(16分)某研究小組擬用粗食鹽(含Ca2+、Mg2+、SO 等)、粗硅(含C及不與Cl2反應的固體雜質)制取純硅,設計如下的工藝流程:
等)、粗硅(含C及不與Cl2反應的固體雜質)制取純硅,設計如下的工藝流程:
試回答下列問題:
(1)工業上一般是利用過量焦炭在高溫下還原石英砂來制取粗硅,寫出該過程的化學方程式:_______________________________________________________________________。
(2)精制粗鹽水所需試劑為①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后順序是下列的________(填下列各項的序號)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知, ,假設該粗鹽水中
,假設該粗鹽水中 的濃度均為0.01 mol·L-1,若向1 L該粗鹽水中逐漸滴入一定量Na2CO3溶液,首先出現的沉淀是__________。
的濃度均為0.01 mol·L-1,若向1 L該粗鹽水中逐漸滴入一定量Na2CO3溶液,首先出現的沉淀是__________。
(3)已知SiCl4的沸點是57.6℃,CC14的沸點是76.8℃。在反應器I中得到的SiCl4粗品中含有CCl4,從中得到純凈SiCl4可采用的方法是下列各項中的________(填序號)。
a.蒸餾 b.干餾 c.分液 d.過濾
反應器Ⅱ中發生反應的化學方程式為__________________________________________。
(4)下圖是用離子交換膜法電解飽和食鹽水的示意圖,電解槽中陰極產生的氣體是_____。產品A的化學式為____________。
若采用無膜電解槽電解飽和食鹽水可制取次氯酸鈉,試寫出該反應的化學方程式__ ___。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
| A.麥芽糖的水解產物能發生銀鏡反應 |
| B.四氟乙烯(CF2=CF2)中所有的原子都在同一個平面上 |
C. 在酸性條件下水解產物是 在酸性條件下水解產物是 和 和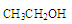 |
| D.淀粉溶液加適量濃硫酸加熱一會兒后,滴入銀氨溶液無銀鏡生成,說明淀粉未水解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com