
【題目】I. 某有機物由C、H、O三種元素組成,球棍模型如圖所示:

(1)該有機物的分子式是_____________;
(2)該有機物可以發生加聚反應,其產物的結構簡式是_____________;
(3)下列有關該有機物的描述中,正確的是____(填序號)。
a. 能與NaHCO3溶液反應
b. 能發生水解反應
c. 不能與溴的CCl4溶液反應
d. 能與酸性高錳酸鉀溶液反應
II. (1)寫出下列化合物的名稱或結構簡式:
①![]() _______________________________,
_______________________________,
②2,5-二甲基-2,4-己二烯的結構簡式:_______________________。
(2)麻黃素又稱黃堿,是我國特定的中藥材麻黃中所含有的一種生物堿,經我國科學家研究發現其結構如圖:

麻黃素中含氧官能團的名稱是_________________,屬于____________類(填“醇”或“酚”)。
【答案】 C3H4O2 ![]() ad 甲酸乙酯
ad 甲酸乙酯 ![]() 羥基 醇
羥基 醇
【解析】I. 根據有機物的球棍模型可知該有機物結構簡式為CH2=CHCOOH,則
(1)該有機物的分子式是C3H4O2;(2)該有機物含有碳碳雙鍵,可以發生加聚反應,其產物的結構簡式是![]() ;(3)下列有關該有機物的描述中,正確的是____(填序號)。
;(3)下列有關該有機物的描述中,正確的是____(填序號)。
a. 含有羧基,能與NaHCO3溶液反應,a正確;b. 不存在酯基,不能發生水解反應,b錯誤;c. 含有碳碳雙鍵,能與溴的CCl4溶液反應,c錯誤;d. 含有碳碳雙鍵,能與酸性高錳酸鉀溶液反應,d正確,答案選ad;
II. (1)①![]() 是酯類,名稱是甲酸乙酯;②2,5-二甲基-2,4-己二烯的結構簡式為
是酯類,名稱是甲酸乙酯;②2,5-二甲基-2,4-己二烯的結構簡式為![]() 。(2)根據麻黃素的結構簡式可知分子中含氧官能團的名稱是羥基,屬于醇。
。(2)根據麻黃素的結構簡式可知分子中含氧官能團的名稱是羥基,屬于醇。


 全優沖刺100分系列答案
全優沖刺100分系列答案 英才點津系列答案
英才點津系列答案科目:高中化學 來源: 題型:
【題目】氨是一種重要的化工產品,是氮肥工業、有機合成工業以及制造硝酸、銨鹽和純堿等的原料。
(1)在一定溫度下,在固定體積的密閉容器中進行可逆反應:N2+3H2![]() 2NH3。該可逆反應達到平衡的標志是________________。
2NH3。該可逆反應達到平衡的標志是________________。
A.3v(H2)正=2v(NH3)逆
B.單位時間生成m mol N2的同時消耗3m mol H2
C.容器內的總壓強不再隨時間而變化
D.混合氣體的密度不再隨時間變化
E.a molN≡N鍵斷裂的同時,有6amolN—H鍵斷裂
F.N2、H2、NH3的分子數之比為1∶3∶2
(2)某化學研究性學習小組模擬工業合成氨的反應。在容積固定為2L的密閉容器內充入1molN2和3molH2,加入合適催化劑(體積可以忽略不計)后在一定溫度壓強下開始反應,并用壓力計監測容器內壓強的變化如下:
反應時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
壓強/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
則從反應開始到25min時,以N2表示的平均反應速率= ;該溫度下平衡常數K= ;
(3) 利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,主要反應如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
圖1中能正確反映平衡常數K隨溫度變化關系的曲線是 ;反應③的△H= kJ·mol-1。
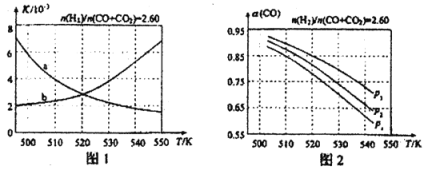
(4)合成氣的組成n(2)/n(CO+CO2)=2.60時體系中的CO平衡轉化率α(CO)與溫度和壓強的關系如圖2所示。圖中的壓強p1、p2、p3由大到小的順序為 ;α(CO)隨溫度升高而減小,其原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于電離平衡常數(K)的說法中正確的是
A. 在一定溫度,相同濃度時電離平衡常數(K)越大可以表示弱電解質電離程度越大
B. 電離平衡常數(K)與溫度無關
C. 不同濃度的同一弱電解質,其電離平衡常數(K)不同
D. 多元弱酸各步電離平衡常數相互關系為K1<K2<K3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廠從廢催化劑(主要含Pt、Al2O3、石墨等)中回收海綿鉑和硫酸鋁晶體。工藝流程如下:
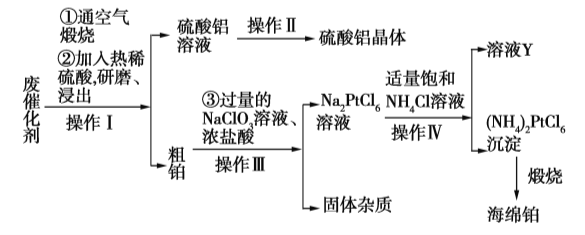
請回答下列問題:
(1)第①步通入空氣煅燒的目的是_____________________________。
(2)第②步用熱酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)寫出第③步反應的離子方程式:_____________________________。
(4)此流程中的四個操作中有三個是相同的,其名稱是__________,在實驗室進行此操作使用的主要玻璃儀器有___________________。溶液Y中可以循環使用的物質是____________(填化學式)。
(5)用返滴定法測定硫酸鋁晶體中鋁的含量:稱取硫酸鋁晶體0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于錐形瓶中,加入0.02 mol·L1的EDTA標準液20.00 mL和緩沖溶液,加熱5 min,冷卻至室溫,加2滴二甲酚橙指示劑,用0.02 mol·L1的標準ZnSO4溶液滴定至終點消耗5.00 mL。則該晶體中鋁的質量分數為___________。(已知Al3+、Zn2+與EDTA反應的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某抗病毒藥物的合成中間體的合成路線如下:

請回答下列問題:
(1)X分子中的官能團名稱為____________;Y分子的結構簡式為_______________。![]() 的一種同分異構體為CH3C≡CCH3,其名稱為__________________。
的一種同分異構體為CH3C≡CCH3,其名稱為__________________。
(2)在合成路線中①、⑤的反應類型分別為①_____________,⑤______________。
(3)寫出反應②、④的化學方程式:反應②____________________________________;
反應④____________________________________。
(4)![]() 具有的性質是__________________(填序號)。
具有的性質是__________________(填序號)。
①能發生取代反應;②能發生加成反應;③能發生中和反應;
④能發生銀鏡反應;⑤能發生消去反應;
(5)該抗病毒藥物的合成中間體有多種同分異構體,能滿足下列條件的結構簡式為__________________。
①可發生銀鏡反應,且能與NaHCO3反應生成CO2;②是芳香族化合物;
③核磁共振氫譜顯示有4種不同化學環境的氫原子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數,下列敘述中正確的是
A. 常溫下64 g S4和S8混合物中含有原子數為2NA
B. 標準狀況下,22.4LHF中含電子數為10NA
C. 標準狀況時,2.24LNO和1.12LO2于密閉容器中充分反應后,其分子數為0.1NA
D. 足量鐵在1mol氯氣中加熱反應,鐵失去的電子數為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質A~F是我們熟悉的單質或化合物,其中A、B均是常見的金屬,且B的合金用量最大;E在常溫下是黃綠色氣體;在適當的條件下,它們之間可以發生如下圖所示的轉化。

試回答下列問題:
⑴ A的化學式是____________;
⑵ 反應F→D的化學方程式是______________________________________。
⑶ 檢驗F中金屬陽離子的常用方法是___________________________________。
⑷ 物質B與鹽酸反應的離子方程式是_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在具有下列電子排布式的原子中,原子半徑最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com