
【題目】如圖是一組檢驗氯氣性質的裝置。
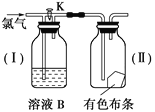
(1)現關閉活塞K,若有色布條是干燥的,溶液B為濃硫酸,則有色布條________;若溶液B為水,則有色布條________;若溶液B為飽和的NaHCO3溶液,則有色布條________。
(2)現打開K,溶液B為氫氧化鈉溶液,通入的Cl2是濕潤的,布條是干燥的,則有色布條________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】氮化鋰是一種優良的貯氫材料,它是一種紫色或紅色的晶狀固體,在空氣中長期暴露,最終會變成碳酸理。氮化理易水解生成氫氧化鋰和氨氣,在空氣中加熱能劇烈燃燒,特別是細粉末狀的氮化鋰: 鋰與氨反應生成LiNH2和H2實驗室用以下裝置制取干燥、純凈的N2并與金屬鋰(密度為0.534g/cm3) 反應制取氮化鋰。

回答下列問題:
(1)連接好裝置進行實驗前必須______________
(2)實驗步驟如下:
①裝藥品 ②點燃C處酒精燈 ③點燃E處酒精燈 ④打開A中分液漏斗
正確的先后順序為________(填序號)
(3)裝置A是制備氨氣的簡易裝置燒瓶中固體是:_______;D裝置的作用是_______.
(4)寫出C中化學方程式為___________
(5)將12.0g鋰放入E反應,實驗結束后稱得E裝置增加了7.0g,計算生成氮化鋰的質量分數為________(結果保留一位小數)。
(6)設計簡單實驗證明E中產物為氮化鋰:_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某原料藥合成路線如下:
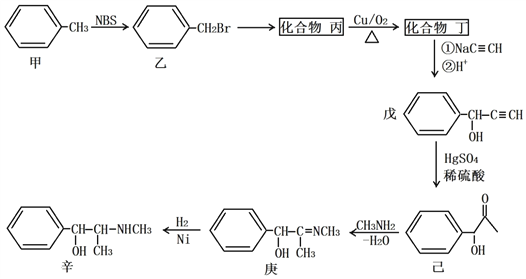
(1)甲→乙的反應類型為_______________;乙→丙的反應條件為__________________。
(2)丁的名稱為_______________;戊的分子式為__________________。
(3)丁發生銀鏡反應的化學方程式為___________________________________________;己→庚的化學方程式為___________________________________________。
(4)化合物己的芳香族同分異構體有多種,A和B是其中的兩類,它們的結構和性質如下:
①已知A遇FeC13溶液發生顯色反應,能和銀氨溶液發生銀鏡反應,苯環上只有兩個對位取代基,則A的結構簡式可能為________________或________________。
②已知B中含有甲基,能發生水解反應,苯環上只有一個取代基,則B的結構有___種。
(5)丁烯酮(![]() )可用作聚合反應單體制取陰離子樹脂,還可用作烷基化劑和合成甾族化合物及維生素A的中間體。請以乙烯和乙炔鈉(NaC≡CH)為原料(無機試劑任選),設計制備丁烯酮的合成路線:___________________。
)可用作聚合反應單體制取陰離子樹脂,還可用作烷基化劑和合成甾族化合物及維生素A的中間體。請以乙烯和乙炔鈉(NaC≡CH)為原料(無機試劑任選),設計制備丁烯酮的合成路線:___________________。
合成路線流程圖示例如:A ![]() B……
B……![]() 目標產物。
目標產物。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在固態金屬氧化物電解池中,高溫共電解H2O—CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示。下列說法不正確的是( )
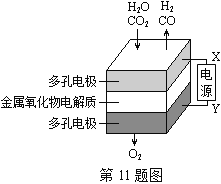
A. X是電源的負極
B. 陰極的反應式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 總反應可表示為:H2O+CO2H2+CO+O2
D. 陰、陽兩極生成的氣體的物質的量之比是1︰1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2和I2在一定條件下能發生反應:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列說法正確的是
A.H2、I2和HI分子中的化學鍵都是非極性共價鍵
B.斷開2 mol HI分子中的化學鍵所需能量約為(c+b+a) kJ
C.相同條件下,1 mol H2 (g)和1mol I2 (g)總能量小于2 mol HI (g)的總能量
D.向密閉容器中加入2 mol H2 (g)和2 mol I2 (g),充分反應后放出的熱量為2a kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,碳酸鈣在水中的沉淀溶解平衡曲線如圖所示,已知25℃時硫酸鈣的Ksp=9.1×10-6。下列說法不正確的是

A. 除去鍋爐水垢中硫酸鈣的辦法是將其轉化為碳酸鈣,然后用酸去除
B. 圖中b點碳酸鈣的結晶速率大于其溶解速率
C. 通過蒸發,可使溶液由a點變化到c點
D. 在25℃時,反應CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常數K=3250
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知常溫時,0.1mol/L某一元酸HA在水中有0.1%發生電離,則該溶液的pH= ,此酸的電離平衡常數K= ,由HA電離出的H+的濃度約為水電離出的H+的濃度的 倍。
(2)含有弱酸HA和其鈉鹽NaA的混合溶液,在化學上用作緩沖溶劑。向其中加入少量酸或堿時,溶液的酸堿性變化不大。
①向該溶液中加入少量鹽酸時,發生反應的離子方程式是 ,向其中加入少量KOH溶液時,發生反應的離子方程式是 。
②現將0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等體積混合,得到緩沖溶液。
a、若HA為HCN,該溶液顯堿性,則溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA為CH3COOH,該溶液顯酸性,溶液中所有的離子按濃度由大到小排列的順序是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將32.64g銅與140mL一定濃度的硝酸反應,銅完全溶解產生的NO和NO2混合氣體在標準狀況下的體積為11.2L。請回答:
(1)NO的體積為________L,NO2的體積為________L。
(2)待產生的氣體全部釋放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為__________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Fe3+具有較強的氧化性,能氧化SO2 。為驗證該反應,用1 mol· L-1 FeCl3溶液與SO2進行實驗。
(1)Fe3+氧化SO2的反應表示為 M。向黃色FeCl3溶液中通入SO2后,預期的實驗現象是__________
(2)用如下圖所示裝置進行實驗。
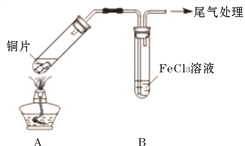
①將A裝置加熱,反應的化學方程式是____________
②A中產生的氣體通入B中后,溶液變為紅色。為證明B中Fe3+氧化了SO2,進行如下兩個實驗方案的實驗:
I 取B中紅色溶液,加入鐵氰化鉀溶液,有藍色沉淀生成,Fe3+與SO2發生氧化還原反應的離子方程式是____________。
II取B中紅色溶液,加入用鹽酸酸化的BaCl2溶液,有白色沉淀,證明B中Fe3+氧化了SO2。比較I和II實驗方案,哪個方案更好,理由是___________。
(3)已知:B中溶液變紅的反應:Fe3++6SO2 ![]() Fe(SO2)63+(紅色 )K=1 表示為N證明該反應是可逆反應的實驗操作是___________。
Fe(SO2)63+(紅色 )K=1 表示為N證明該反應是可逆反應的實驗操作是___________。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快變為紅色;停止通入SO2,靜置;15分鐘后溶液逐漸變為黃色;60分鐘后變為淺綠色。說明B中既發生反應M,也發生了反應N。結合反應速率和平衡移動原理解釋溶液很快變紅,最終變淺綠的原因____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com