
【題目】(1)已知拆開1 mol H—H鍵、1 mol N—H鍵、1 mol N≡N鍵需要的能量分別是436 kJ、391 kJ、946 kJ,則N2與H2反應生成NH3的熱化學方程式為_________________。
(2)已知化學反應A2(g)+B2(g)===2AB(g)的能量變化如圖所示,回答下列問題:
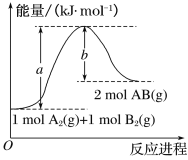
①該反應的ΔH_______0(填 “大于”“小于”或“等于”);
②反應物的總鍵能為______________;
③寫出該反應的熱化學方程式________________________________。
(3)聯氨(又稱肼,N2H4,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料,回答下列問題:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
寫出聯氨的結構式_______________,上述反應熱效應之間的關系式為ΔH4=__________,聯氨和N2O4可作為火箭推進劑的主要原因為_______________________________。
【答案】N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1大于akJ·mol-1A2(g)+B2(g)===2AB(g) ΔH=+(a-b)kJ·mol-1![]() 2ΔH3-2ΔH2-ΔH1反應放熱量大、產生大量氣體、無污染
2ΔH3-2ΔH2-ΔH1反應放熱量大、產生大量氣體、無污染
【解析】
(1)根據“ΔH=反應物的鍵能總和-生成物的鍵能總和”計算。
(2)根據“反應物的總能量小于生成物的總能量”判斷反應為吸熱反應。結合圖像書寫熱化學方程式。
(3)根據價鍵規則書寫N2H4的結構式;根據蓋斯定律分析反應熱之間的關系。
(1)N2與H2反應生成NH3的化學方程式為N2(g)+3H2(g)=2NH3(g),該反應的ΔH=反應物的鍵能總和-生成物的鍵能總和=E(N≡N)+3E(H—H)-6E(N—H)=946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;N2與H2反應生成NH3的熱化學方程式為:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol。
(2)①1molA2(g)和1molB2(g)具有的總能量小于2molAB(g)具有的總能量,反應A2(g)+B2(g)=2AB(g)為吸熱反應,ΔH大于0。
②根據圖像,反應物的總鍵能為akJ/mol。
③根據圖像,該反應的ΔH=+(a-b)kJ/mol,該反應的熱化學方程式為:A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ/mol。
(3)N原子最外層有5個電子,H原子最外層有1個電子,根據價鍵規則,N2H4的電子式為![]() ,N2H4的結構式為
,N2H4的結構式為![]() 。應用蓋斯定律,消去O2(g)、H2(g),將③×2-①-②×2得④,則ΔH4=2ΔH3-ΔH1-2ΔH2。根據反應④知,聯氨和N2O4可作為火箭推進劑的主要原因為:反應放熱量大、產生大量氣體、無污染。
。應用蓋斯定律,消去O2(g)、H2(g),將③×2-①-②×2得④,則ΔH4=2ΔH3-ΔH1-2ΔH2。根據反應④知,聯氨和N2O4可作為火箭推進劑的主要原因為:反應放熱量大、產生大量氣體、無污染。


 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源: 題型:
【題目】已知25℃時,電離常數Ka(HF)=3.6×104 mol/L,溶度積常數Ksp(CaF2)=1.46×1010 mol3·L3。現向1 L0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,則下列說法中,正確的是
A. 25℃時,0.1 mol/L HF溶液中pH=1
B. Ksp(CaF2)隨溫度和濃度的變化而變化
C. 該體系中Ksp(CaF2)=![]()
D. 該體系中有CaF2沉淀產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、W、M、N為短周期元素且原子序數依次增大,X與M、W與N分別同主族,且元素X、Y、Z、W分屬兩個短周期,它們四者原子序數之和為22,最外層電子數之和為16,在化合物Y2X6、Z2X4、X2W2中,相應分子內各原子最外層電子都滿足穩定結構,請回答下列問題:
(1)Y元素在周期表中的位置是____________,X、Y、Z、W、M的原子半徑由大到小的順序為:__________________________(用元素符號表示)。
(2)寫出Y2X6的電子式_____;Z2X4結構式______;X2W2所含化學鍵的類型______。
(3)用電子式描述M2N所形成化合物的形成過程_________________________。
(4)均含X、W、M、N四種元素的兩種化合物相互反應有刺激性氣味氣體放出,反應的離子方程式為__________________。
(5)火箭發動機曾經利用Z2X4作燃料X2W2作助燃劑,產物環保無污染,寫出二者反應的方程式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)研究CO2在海洋中的轉移和歸宿,是當今海洋科學研究的前沿領域。
(1)溶于海水的CO2主要以4種無機碳形式存在,其中HCO3-占95%,寫出CO2溶于水產生HCO3-的方程式: 。
(2)在海洋循環中,通過下圖所示的途徑固碳。

①寫出鈣化作用的離子方程式: 。
②同位素示蹤法證實光合作用釋放出的O2只來自于H2O,用18O標記物質的光合作用的化學方程式如下,將其補充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解無機碳占海水總碳的95%以上,其準確測量是研究海洋碳循環的基礎,測量溶解無機碳,可采用如下方法:
①氣提、吸收CO2,用N2從酸化后的還說中吹出CO2并用堿液吸收(裝置示意圖如下),將虛線框中的裝置補充完整并標出所用試劑。

②滴定。將吸收液洗后的無機碳轉化為NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解無機碳的濃度= mol/L。
(4)利用下圖所示裝置從海水中提取CO2,有利于減少環境溫室氣體含量。

①結合方程式簡述提取CO2的原理: 。
②用該裝置產生的物質處理b室排出的海水,合格后排回大海。處理至合格的方法是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學鍵類型的敘述正確的是( )
A.全部由非金屬構成的化合物中肯定不存在離子鍵
B.所有物質中都存在化學鍵
C.已知乙炔的結構式為H—C≡C—H,則乙炔中存在2個σ鍵(C—H)和3個π鍵(C≡C)
D.乙烷分子中只存在σ鍵,不存在π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今有濃度均為3mol·L-1的鹽酸和硫酸各100mL,分別加入等質量的Fe粉,反應完畢后生成氣體的質量之比為3:4,則加入鹽酸中的鐵粉的質量為
A. 5.6g B. 8.4g C. 11.2g D. 16.8g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述正確的是( )
4NO(g)+6H2O(g),下列敘述正確的是( )
A. 達到化學平衡時,4v正(O2)=5v逆(NO)
B. 若單位時間內生成xmol NO的同時,消耗xmol NH3,則反應達到平衡狀態
C. 若有5 mol O===O鍵斷裂,同時有12 mol H—O鍵形成,此時必為化學平衡狀態
D. 化學平衡時,化學反應速率關系是2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將兩種氣體M和N通入容積為VL的密閉容器中進行反應,M和N的物質的量與時間的關系如圖所示,下列說法正確的是( )

A. 0~t2內用M表示的平均反應速率是2/t2(mol·L-1·min-1)
B. t1~t2內容器內的壓強逐漸減小
C. 該反應的方程式為N![]() 2M
2M
D. t2與t3時刻的混合氣體的平均相對分子質量相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com