
【題目】2mol H2SO4的質量為 g,所含氧原子數目為 , 完全中和這些硫酸,消耗NaOH的物質的量是mol.
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖1表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化
B. 圖2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲線
C. 圖3表示KNO3的溶解度曲線,圖中a點所示的溶液是80℃時KNO3的不飽和溶液
D. 圖4表示某可逆反應生成物的量隨反應時間變化的曲線,由圖知t時反應物轉化率最大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性質的不銹鋼,在下圖裝置中,觀察到圖1裝置銅電極上產生大量的無色氣泡,而圖2裝置中銅電極上無氣體產生,鉻電極上產生大量有色氣體,則下列敘述正確的是( )

A.圖2裝置中Cu電極上發生的電極反應式為:Cu-2e-==Cu2+
B.圖1為原電池裝置,Cu電極上產生的是O2
C.由實驗現象可知:金屬活動性Cu>Cr
D.兩個裝置中,電流均由Cr電極流向Cu電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)。CO2(g)的平衡物質的量濃度c(CO2)與溫度T的關系如圖所示。下列說法錯誤的是
CO2(g)+H2(g)。CO2(g)的平衡物質的量濃度c(CO2)與溫度T的關系如圖所示。下列說法錯誤的是
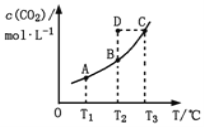
A. 反應CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH>0
CO2(g)+H2(g)的 ΔH>0
B. 在T2時,若反應處于狀態D,則一定有ν正<ν逆
C. 平衡狀態A與C相比,平衡狀態A的c(CO)小
D. 若T1、T2時的平衡常數分別為K1、K2,則K1<K2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅焙砂主要含ZnO、ZnFe2O4,還含有少量CaO、FeO、CuO、NiO等氧化物。下圖是工業上利用鋅焙砂制取金屬鋅的流程圖。
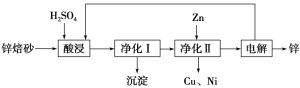
(1)酸浸時ZnFe2O4會生成兩種鹽,該反應的化學方程式為_____________________________。
(2)凈化Ⅰ操作分為兩步:第一步是將溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+轉化為Fe(OH)3沉淀。
①寫出酸性條件下H2O2與Fe2+反應的離子方程式: _________________________________。
②25 ℃時,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③凈化Ⅰ生成的沉淀中還含有溶液中的懸浮雜質,溶液中的懸浮雜質被共同沉淀的原因是__________________________________。
(3)本流程中可以循環利用的物質除硫酸鋅外還有__________________。
(4)若沒有凈化Ⅱ操作,則對鋅的制備帶來的影響是__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1
則反應NO2(g)+SO2(g)SO3(g)+NO(g)的△H=______kJmol-1.
(2)一定條件下,將NO2與SO2以物質的量比為1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是______。[不考慮N2O4(g)![]() 2NO2(g)的轉化]
2NO2(g)的轉化]
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1mol SO3的同時生成1mol NO2
(3)測得上述反應平衡時NO2與SO2物質的量比為1:6,則平衡時SO2的轉化率為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列物質,正鹽:鉀鹽、鈉鹽、銨鹽、鋇鹽;酸:鹽酸、硝酸、醋酸、稀硫酸.在水溶液中符合離子方程式:2H++CO32﹣= CO2↑+H2O的化學反應的組合共有( )
A.6個 B.9個 C.12個 D.15個
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com