
下圖是煤化工產(chǎn)業(yè)鏈的一部分,試運(yùn)用所學(xué)知識(shí),解決下列問(wèn)題: 
I.已知該產(chǎn)業(yè)鏈中某反應(yīng)的平衡表常數(shù)達(dá)式為:K= ,它所對(duì)應(yīng)反應(yīng)的化學(xué)方程式為 。
,它所對(duì)應(yīng)反應(yīng)的化學(xué)方程式為 。
II.二甲醚(CH3OCH3)在未來(lái)可能替代柴油和液化氣作為潔凈液體燃料使用,工業(yè)上以CO和H2為原料生產(chǎn)CH3OCH3。工業(yè)制備二甲醚在催化反應(yīng)室中(壓力2.0~10.0Mpa,溫度230~280℃)進(jìn)行下列反應(yīng):
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反應(yīng)室中總反應(yīng)的熱化學(xué)方程式為 。
830℃時(shí)反應(yīng)③的K=1.0,則在催化反應(yīng)室中反應(yīng)③的K 1.0(填“>”、“<”或“=”)。
(2)在某溫度下,若反應(yīng)①的起始濃度分別為:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后達(dá)到平衡,CO的轉(zhuǎn)化率為50%,則5 min內(nèi)CO的平均反應(yīng)速率為 ;若反應(yīng)物的起始濃度分別為:c(CO)=4 mol/L,c(H2)=a mol/L;達(dá)到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)反應(yīng)②在t℃時(shí)的平衡常數(shù)為400,此溫度下,在0.5L的密閉容器中加入一定的甲醇,反應(yīng)到某時(shí)刻測(cè)得各組分的物質(zhì)的量濃度如下:
| 物質(zhì) | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
I.C(s) + H2O(g)  CO(g)+H2(g) (1分)
CO(g)+H2(g) (1分)
II.(1)3CO(g)+3H2(g)  CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1 > (1分)
CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1 > (1分)
(2)0.1mol/(L·min) (1分) 5.4 (1分)
(3)大于(1分) 1.6mol/L (1分)
(4)CH3OCH3 -12e-+16OH - = 2CO32-+11H2O (1分) 9.6g (2分)
解析試題分析:I.根據(jù)題給平衡常數(shù)表達(dá)式,結(jié)合質(zhì)量守恒定律寫(xiě)出,化學(xué)方程式為
C(s) + H2O(g)  CO(g)+H2(g);II.(1)根據(jù)蓋斯定律,①×2+②+③得催化反應(yīng)室中總反應(yīng)的熱化學(xué)方程式為3CO(g)+3H2(g)
CO(g)+H2(g);II.(1)根據(jù)蓋斯定律,①×2+②+③得催化反應(yīng)室中總反應(yīng)的熱化學(xué)方程式為3CO(g)+3H2(g)  CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1;該反應(yīng)放熱,降溫平衡向正向移動(dòng),K增大,故在催化反應(yīng)室中反應(yīng)③的K>1.0;(2)根據(jù)v=△c/△t,將題給數(shù)據(jù)代入計(jì)算,v(CO)= 0.1mol/(L·min);根據(jù)平衡計(jì)算——三行式計(jì)算。
CH3OCH3(g) +CO2(g) △H1=-246.1kJ·mol-1;該反應(yīng)放熱,降溫平衡向正向移動(dòng),K增大,故在催化反應(yīng)室中反應(yīng)③的K>1.0;(2)根據(jù)v=△c/△t,將題給數(shù)據(jù)代入計(jì)算,v(CO)= 0.1mol/(L·min);根據(jù)平衡計(jì)算——三行式計(jì)算。
CO(g)+2H2(g) CH3OH(g) CO(g)+2H2(g)
CH3OH(g) CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始濃度(mol/L) 1 2.4 0 4 a 0
轉(zhuǎn)化濃度(mol/L) 0.5 1 0.5 2 4 2
平衡濃度(mol/L) 0.5 1.4 0.5 2 a-4 2
將有關(guān)數(shù)據(jù)代入平衡常數(shù)表達(dá)式,計(jì)算得a=5.4;
(3)①根據(jù)信息知,Q= c(CH3OCH3) c(H2O)/ c2(CH3OH),代入數(shù)據(jù)計(jì)算得Q=2.4,Q<K,反應(yīng)正向進(jìn)行,v正大于v逆;②根據(jù)平衡計(jì)算——三行式進(jìn)行計(jì)算。平衡時(shí)二甲醚的物質(zhì)的量濃度是1.6mol/L;
(4)以二甲醚、空氣、KOH 溶液為原料,以石墨為電極可直接構(gòu)成燃料電池,二甲醚發(fā)生氧化反應(yīng),在負(fù)極發(fā)生反應(yīng),根據(jù)原子守恒和電荷守恒,該電池的負(fù)極反應(yīng)式為CH3OCH3 -12e-+16OH - = 2CO32-+11H2O;根據(jù)電子守恒計(jì)算析出銅的質(zhì)量,2m(Cu)/64=1.12/22.4×0.5×12,m(Cu)=9.6g。
考點(diǎn):考查化學(xué)平衡計(jì)算、蓋斯定律和電化學(xué)。



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:填空題
2013年全國(guó)各地都遭遇“十面霾伏”。其中,機(jī)動(dòng)車(chē)尾氣和燃煤產(chǎn)生的煙氣對(duì)空氣質(zhì)量惡化貢獻(xiàn)較大。
(1)汽車(chē)尾氣凈化的主要原理為:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
若該反應(yīng)在絕熱、恒容的密閉體系中進(jìn)行,下列示意圖正確且能說(shuō)明反應(yīng)在進(jìn)行到t1時(shí)刻達(dá)到平衡狀態(tài)的是 (填代號(hào))。
(下圖中υ正、K、n、w分別表示正反應(yīng)速率、平衡常數(shù)、物質(zhì)的量、質(zhì)量分?jǐn)?shù))
(2)機(jī)動(dòng)車(chē)尾氣和煤燃燒產(chǎn)生的煙氣含氮的氧化物,用CH4催化還原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)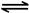 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
寫(xiě)出CH4催化還原N2O4(g)生成N2和H2O(l)的熱化學(xué)方程式: 。
(3)用NH3催化還原NOX也可以消除氮氧化物的污染。如圖,采用NH3作還原劑,煙氣以一定的流速通過(guò)兩種不同催化劑,測(cè)量逸出氣體中氮氧化物含量,從而確定煙氣脫氮率(注:脫氮率即氮氧化物轉(zhuǎn)化率),
反應(yīng)原理為:NO(g) +NO2(g)+2NH3(g)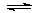 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。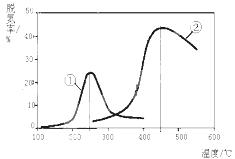
①該反應(yīng)的△S 0,△H 0(填“>”、“=”或 “<”)。
②對(duì)于氣體反應(yīng),用某組分(B)的平衡壓強(qiáng)(pB)代替物質(zhì)的量濃度(cB)也可以表示平衡常數(shù)(記作KP),
則上述反應(yīng)的KP= 。
③以下說(shuō)法正確的是 。
A.第②種催化劑比第①種催化劑脫氮率高
B.相同條件下,改變壓強(qiáng)對(duì)脫氮率沒(méi)有影響
C.催化劑①、②分別適合于250℃和450℃左右脫氮
(4)NO2、O2和熔融NaNO3可制作燃料電池,其原理見(jiàn)圖。該電池在使用過(guò)程中石墨I(xiàn)電極上生成氧化物Y,其電極反應(yīng)為 。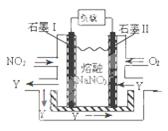
(5)硝酸工業(yè)尾氣中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反應(yīng)生成對(duì)大氣無(wú)污染的氣體。1 mol尿素能吸收工業(yè)尾氣中氮氧化物(假設(shè)NO、NO2體積比為1:1)的質(zhì)量為_(kāi)__________g。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
國(guó)家擬于“十二五”期間將SO2的排放量減少8%,研究SO2綜合利用意義重大。
(1)已知25℃時(shí):SO2(g)+2CO(g)=2CO2(g)+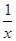 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+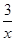 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
則CO與Sx生成COS反應(yīng)的熱化學(xué)方程式是________________________。
(2)有人設(shè)想按如圖所示裝置用廢氣中的SO2生產(chǎn)硫酸。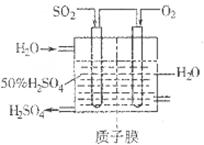
寫(xiě)出SO2電極的電極反應(yīng)式__________________________。
(3)提高反應(yīng)2SO2(g)+O2(g)  2SO3(g) △H<0中SO2的轉(zhuǎn)化率是控制SO2排放的關(guān)鍵措施之一。某課外活動(dòng)小組進(jìn)行了如下探究:
2SO3(g) △H<0中SO2的轉(zhuǎn)化率是控制SO2排放的關(guān)鍵措施之一。某課外活動(dòng)小組進(jìn)行了如下探究:
①T1溫度時(shí),在2L的密閉容器中加入4.0molSO2和2.0molO2,5 min后反應(yīng)達(dá)到平衡,二氧化硫的轉(zhuǎn)化率為50%,前5 min內(nèi)SO2的平均反應(yīng)速率為_(kāi)__________。
②在①中的反應(yīng)達(dá)到平衡后,改變下列條件,能使SO2的轉(zhuǎn)化率及SO3的平衡濃度都比原來(lái)增大的是
_________(填序號(hào))。
a.溫度和容器體積不變,充入1.0molHe (g)
b.溫度和容器體積不變,充入2molSO2和lmolO2
c.溫度和容器體積不變,充入1.0molSO2
d.在其他條件不變時(shí),減小容器的容積
③在其他條件不變的情況下,探究起始時(shí)氧氣物質(zhì)的量對(duì)2SO2(g)+O2(g)  2SO3(g)反應(yīng)的影響,實(shí)驗(yàn)結(jié)果如圖所示。(圖中T表示溫度,n表示物質(zhì)的量):在a、b、c三點(diǎn)所處的平衡狀態(tài)中,SO2的轉(zhuǎn)化率最高的是____,溫度T1______T2(填“>”“<”或“=”)。
2SO3(g)反應(yīng)的影響,實(shí)驗(yàn)結(jié)果如圖所示。(圖中T表示溫度,n表示物質(zhì)的量):在a、b、c三點(diǎn)所處的平衡狀態(tài)中,SO2的轉(zhuǎn)化率最高的是____,溫度T1______T2(填“>”“<”或“=”)。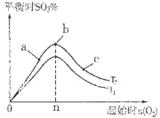
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
化工行業(yè)的發(fā)展必須符合國(guó)家節(jié)能減排的總體要求。請(qǐng)回答下列問(wèn)題:
(1)已知C(s)+H2O(g)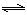 CO(g)+H2(g),則該反應(yīng)的平衡常數(shù)表達(dá)式為 。
CO(g)+H2(g),則該反應(yīng)的平衡常數(shù)表達(dá)式為 。
(2)已知在一定溫度下,
C(s)+CO2(g) 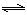 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 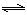 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)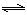 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
則△H1、△H2、△H3之間的關(guān)系是: 。
(3)通過(guò)研究不同溫度下平衡常數(shù)可以解決某些實(shí)際問(wèn)題。已知等體積的一氧化碳和水蒸氣進(jìn)入反應(yīng)時(shí),會(huì)發(fā)生如下反應(yīng): CO(g)+H2O(g) 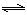 H2(g)+CO2(g),該反應(yīng)平衡常數(shù)隨溫度的變化如表所示。
H2(g)+CO2(g),該反應(yīng)平衡常數(shù)隨溫度的變化如表所示。
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數(shù)K | 9.94 | 9 | 1 |
 2NO2(g) △H>0在溫度為T(mén)1、T2時(shí),平衡體系中NO2的體積分?jǐn)?shù)隨壓強(qiáng)變化曲線(xiàn)如圖所示。下列說(shuō)法正確的是 :
2NO2(g) △H>0在溫度為T(mén)1、T2時(shí),平衡體系中NO2的體積分?jǐn)?shù)隨壓強(qiáng)變化曲線(xiàn)如圖所示。下列說(shuō)法正確的是 :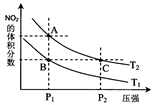
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
(1)能源的開(kāi)發(fā)利用與人類(lèi)社會(huì)的可持續(xù)性發(fā)展息息相關(guān)。
已知:① Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H1="a" kJ/mol
②CO(g)+1/2 O2(g)=CO2(g) △H2="b" kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3="c" kJ/mol
則C的燃燒熱____________________________kJ.mol-1
(2)某實(shí)驗(yàn)小組模擬工業(yè)合成氨反應(yīng)N2+3H2 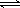 2NH3 △H ="-92.4" kJ/mol,開(kāi)始他們將N2和H2混合氣體20mol (體積比1:1)充入5L合成塔中.反應(yīng)前壓強(qiáng)為P0,反應(yīng)過(guò)程中壓強(qiáng)用P表示,反應(yīng)過(guò)程中P/P0與時(shí)間t的關(guān)系如圖所示。請(qǐng)回答下列問(wèn)題:
2NH3 △H ="-92.4" kJ/mol,開(kāi)始他們將N2和H2混合氣體20mol (體積比1:1)充入5L合成塔中.反應(yīng)前壓強(qiáng)為P0,反應(yīng)過(guò)程中壓強(qiáng)用P表示,反應(yīng)過(guò)程中P/P0與時(shí)間t的關(guān)系如圖所示。請(qǐng)回答下列問(wèn)題: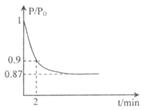
①反應(yīng)達(dá)平衡的標(biāo)志是(填字母代號(hào))_____________
A.壓強(qiáng)保持不變
B.氣體密度保持不變
C.NH3的生成速率是N2的生成速率的2倍
②2min時(shí),以C(N2)變化表示的平均反應(yīng)速率為_(kāi)__________
③若提高N2的轉(zhuǎn)化率可采取的措施有_______________
A.向體系中按體積比1:1再充入N2和H2
B.分離出NH3
C.升高溫度
D.充入He氣使壓強(qiáng)增大
E.加入一定量的N2
(3)25°C時(shí),BaCO3和BaSO4的溶度積常數(shù)分別是8×10-9和1×10-10,某含有BaCO3沉淀的懸濁液中c(CO32-)=0.2mol/L,如果加入等體積的Na2SO4溶液,若要產(chǎn)生 BaSO4沉淀,加入Na2SO4溶液的物質(zhì)的量濃度最小是________mol /L。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
(15分)能源的開(kāi)發(fā)、利用與人類(lèi)社會(huì)的可持續(xù)發(fā)展息息相關(guān),怎樣充分利用好能源是擺在人類(lèi)面前的重大課題。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
則反應(yīng):4Fe(s)+3O2(g)= 2Fe2O3(s)的焓變△H= kJ·mol-1。
Ⅱ.(1)依據(jù)原電池的構(gòu)成原理,下列化學(xué)反應(yīng)在理論上可以設(shè)計(jì)成原電池的是 (填序號(hào))。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液為電解質(zhì)溶液,依據(jù)所選反應(yīng)可以設(shè)計(jì)成一個(gè)原電池,請(qǐng)寫(xiě)出該原電池的電極反應(yīng)。
負(fù)極: ,
正極: 。
(2)二氧化氯(ClO2)是一種高效安全的自來(lái)水消毒劑。ClO2是一種黃綠色氣體,易溶于水。實(shí)驗(yàn)室以NH4Cl、鹽酸、NaClO2為原料制備ClO2流程如下:
已知:電解過(guò)程中發(fā)生的反應(yīng)為:
NH4Cl+2HCl NCl3+3H2↑;假設(shè)NCl3中氮元素為+3價(jià)。
NCl3+3H2↑;假設(shè)NCl3中氮元素為+3價(jià)。
①寫(xiě)出電解時(shí)陰極的電極反應(yīng)式 。
②在陽(yáng)極上放電的物質(zhì)(或離子)是 。
③除去ClO2中的NH3可選用的試劑是 (填序號(hào))
A.生石灰 B.堿石灰 C.濃H2SO4 D.水
④在生產(chǎn)過(guò)程中,每生成1mol ClO2,需消耗 mol NCl3。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
運(yùn)用化學(xué)反應(yīng)原理知識(shí)研究如何利用CO、SO2等污染物有重要意義。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+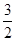 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+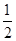 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+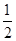 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
則CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能夠增大上述合成甲醇反應(yīng)的反應(yīng)速率的是________(填寫(xiě)序號(hào)).
a.使用高效催化劑 b.降低反應(yīng)溫度
c.增大體系壓強(qiáng) d.不斷將CH3OH從反應(yīng)混合物中分離出來(lái)
(3)在一定壓強(qiáng)下,容積為V L的容器中充入a mol CO與2a mol H2,在催化劑作用下反應(yīng)生成甲醇,平衡轉(zhuǎn)化率與溫度、壓強(qiáng)的關(guān)系如右圖所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃時(shí),該反應(yīng)的化學(xué)平衡常數(shù)K=________(mol·L-1)-2;
③在其它條件不變的情況下,再增加a mol CO和2a molH2,達(dá)到新平衡時(shí),CO的轉(zhuǎn)化率________(填“增大”、“減小”或“不變”)。
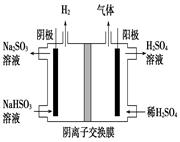
(4)某科研小組用SO2為原料制取硫酸。
①利用原電池原理,用SO2、O2和H2O來(lái)制備硫酸,該電池用多孔材料作電極,它能吸附氣體,同時(shí)也能使氣體與電解質(zhì)溶液充分接觸。請(qǐng)寫(xiě)出該電池的負(fù)極的電極反應(yīng)式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后電解該溶液可制得硫酸。電解原理示意圖如下圖所示。請(qǐng)寫(xiě)出開(kāi)始時(shí)陽(yáng)極反應(yīng)的電極反應(yīng)式________________。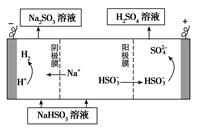
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
硫酸鹽主要來(lái)自地層礦物質(zhì),多以硫酸鈣、硫酸鎂的形態(tài)存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1=" +1011.0" kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)="2CO(g)" ;ΔH3=-221.0 kJ · mol-1
則反應(yīng)④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,該反應(yīng)能自發(fā)進(jìn)行的原因是 ;工業(yè)上制備N(xiāo)a2S不用反應(yīng)①,而用反應(yīng)④的理由是 。
(2)已知不同溫度下2SO2+O2 2SO3的平衡常數(shù)見(jiàn)下表。
2SO3的平衡常數(shù)見(jiàn)下表。
| 溫度(℃) | 527 | 758 | 927 |
| 平衡常數(shù) | 784 | 1.0 | 0.04 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
我國(guó)是個(gè)鋼鐵大國(guó),鋼鐵產(chǎn)量為世界第一,高爐煉鐵是最為普遍的煉鐵方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 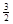 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1 反應(yīng):Fe2O3(s)+ 3CO(g)
反應(yīng):Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反應(yīng)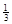 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
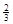 Fe(s)+ CO2(g)在1000℃的平衡常數(shù)等于4.在一個(gè)容積為10L的密閉容器中,1000℃時(shí)加入Fe、Fe2O3、CO、CO2各1.0mol,反應(yīng)經(jīng)過(guò)l0min后達(dá)到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常數(shù)等于4.在一個(gè)容積為10L的密閉容器中,1000℃時(shí)加入Fe、Fe2O3、CO、CO2各1.0mol,反應(yīng)經(jīng)過(guò)l0min后達(dá)到平衡.
(1)CO的平衡轉(zhuǎn)化率=____________.
(2)欲提高CO的平衡轉(zhuǎn)化率,促進(jìn)Fe2O3的轉(zhuǎn)化,可采取的措施是________.
a.提高反應(yīng)溫度
b.增大反應(yīng)體系的壓強(qiáng)
c.選取合適的催化劑
d.及時(shí)吸收或移出部分CO2
e.粉碎礦石,使其與平衡混合氣體充分接觸
Ⅲ.高爐煉鐵產(chǎn)生的廢氣中的CO可進(jìn)行回收,使其在一定條件下和H2反應(yīng)制備甲醇:
CO(g)+ 2H2(g) CH3OH(g).請(qǐng)根據(jù)圖示回答下列問(wèn)題:
CH3OH(g).請(qǐng)根據(jù)圖示回答下列問(wèn)題: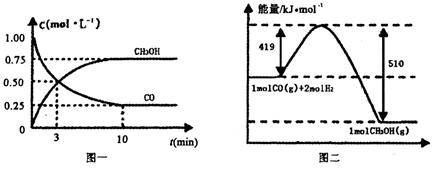
(1)從反應(yīng)開(kāi)始到平衡,用H2濃度變化表示平均反應(yīng)速率v(H2)=________.
(2)若在溫度和容器相同的三個(gè)密閉容器中,按不同方式投入反應(yīng)物,測(cè)得反應(yīng)達(dá)到平衡吋的有關(guān)數(shù)據(jù)如下表:
| 容器 | 反應(yīng)物投入的量 | 反應(yīng)物的 轉(zhuǎn)化率 | CH3OH的濃度 | 能量變化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ熱量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ熱量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ熱量 |
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com