
【題目】汽車尾氣是城市主要空氣污染物,汽車內燃機工作時發生反應:N2(g) + O2(g)![]() 2NO(g),是導致汽車尾氣中含有NO的原因之一。
2NO(g),是導致汽車尾氣中含有NO的原因之一。
(1)已知H2或CO可以催化還原NO以達到消除污染的目的。N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1,2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1,則H2(g)與NO(g)反應生成N2(g)和H2O(l)的熱化學方程式是_________________________,判斷該反應自發進行的條件:_______________(填“高溫自發”或“低溫自發”)。
(2)當質量一定時,增大固體催化劑的表面積可提高化學反應速率。下圖表示在其他條件不變時,反應:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g)中NO的濃度[c(NO)]隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線。
2CO2(g) + N2(g)中NO的濃度[c(NO)]隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線。

①則該反應的△H___0(填“>”或“<”)。
②若催化劑的表面積S1>S2 ,在該圖中畫出c(NO)在T1、S2條件下達到平衡過程中的變化曲線___。
(3)某小組往一恒溫恒壓容器充入9mol N2和23mol H2模擬合成氨反應,圖C為不同溫度下平衡混合物中氨氣的體積分數與總壓強(p)的關系圖.若體系在T2、60MPa下達到平衡.

①能判斷N2(g)+3H2(g)2NH3(g)達到平衡的是___(填序號).
a.容器內壓強不再發生變化 b.混合氣體的密度不再發生變化
c.v正(N2)=3v逆(H2) d.混合氣體的平均相對分子質量不再發生變化
②此時N2的平衡分壓為_________MPa.(分壓=總壓×物質的量分數)。計算出此時的平衡常數Kp=__________(用平衡分壓代替平衡濃度計算,結果保留2位有效數字)。
【答案】2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H=-752.1 kJ·mol-1 低溫自發 <  bd 9 0.043
bd 9 0.043
【解析】
(1)根據蓋斯定律,由已知熱化學方程式乘以適當的系數進行加減構造目標熱化學方程式,反應熱也乘以相應的系數進行相應的計算;根據自發反應進行的判斷公式判斷;
(2)①根據到達平衡的時間,判斷溫度高低,再根據不同溫度下到達平衡時NO的濃度高低,判斷溫度對平衡的影響,據此判斷反應熱效應;
②催化劑的表面積S1>S2,則催化劑S1到達平衡的時間比催化劑S2短,催化劑不影響平衡移動,平衡時NO的濃度相同,據此作圖;
(3)①可逆反應達到平衡狀態時,正逆反應速率相等,反應體系中各物質的物質的量、物質的量濃度、百分含量以及由此引起的一系列物理量不變;
②利用三段法“開始 變化 平衡”列出各組分數據,先計算各組分平衡分壓,再計算平衡常數Kp。
(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol,②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJmol-1,依據蓋斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol;由于正反應放熱(△H<0),且正反應方向氣體體積減小,為熵減小的方向,即△S<0,△H-T△S<0,反應自發進行,所以T較小才可以,即低溫下自發,故答案為:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;低溫自發;
(2)①溫度T2到達平衡的時間短,反應速率快,故溫度T2>T1,溫度越高,平衡時NO的濃度越高,說明升高溫度平衡向逆反應移動,故正反應為放熱反應,即△H<0,故答案為:<;
②催化劑的表面積S1>S2,則催化劑S1到達平衡的時間比催化劑S2短,催化劑不影響平衡移動,平衡時NO的濃度相同,故c(NO)在T1、S2條件下達到平衡過程中的變化曲線為 ,故答案為:
,故答案為: ;
;
(3)①a.該反應是恒壓,所以無論反應是否達到平衡狀態壓強都不變,所以不能據此判斷平衡狀態,故a錯誤;
b.反應前后氣體總質量不變但容器體積改變,所以混合氣體的密度改變,當混合氣體密度不變時該反應達到平衡狀態,故b正確;
c.3v正(N2)=v逆(H2)時該反應達到平衡狀態,當v正(N2)=3v逆(H2)時該反應沒有達到平衡狀態,故c錯誤;
d.反應前后混合氣體質量不變,但氣體總物質的量減小,所以混合氣體相對分子質量增加,當混合氣體的平均相對分子質量不再發生變化時,正逆反應速率相等,反應達到平衡狀態,故d正確;故選bd;
②若體系在T2、60MPa下達到平衡,相同溫度下,氣體的體積分數等于其物質的量分數,設平衡時n(NH3)=xmol,
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
開始(mol) 9 23 0
反應(mol) 0.5x 1.5x x
平衡(mol) 9-0.5x 23-1.5x x
平衡時氨氣體積分數=x/(32-x)=0.6,解得x=12,則N2的平衡分壓為![]() ×60MPa=9 MPa,氨氣的分壓=60%×60MPa=36MPa,氫氣分壓=60MPa-9MPa-36MPa=15MPa,此時的平衡常數Kp=(36MPa)2/9 MPa×(15MPa)3=0.043(MPa)-2,故答案為:9;0.043(MPa)-2。
×60MPa=9 MPa,氨氣的分壓=60%×60MPa=36MPa,氫氣分壓=60MPa-9MPa-36MPa=15MPa,此時的平衡常數Kp=(36MPa)2/9 MPa×(15MPa)3=0.043(MPa)-2,故答案為:9;0.043(MPa)-2。


科目:高中化學 來源: 題型:
【題目】某科研人員提出HCHO(甲醛)與O2在羥基磷灰石(HAP)表面催化生成H2O的歷程,該歷程示意圖如下(圖中只畫出了 HAP的部分結構):
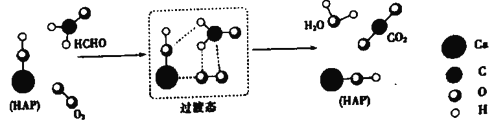
下列說法不正確的是
A. HAP能提高HCHO與O2的反應速率
B. HCHO在反應過程中,有C-H鍵發生斷裂
C. 根據圖示信息,CO2分子中的氧原子全部來自O2
D. 該反應可表示為:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫恒壓密閉容器M(如圖Ⅰ)和恒溫恒容密閉容器N(如圖Ⅱ)中,兩容器中均加入a molA和a molB,起始時兩容器體積均為VL,發生如下反應并達到化學平衡狀態:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡時M中A、B、C的物質的量之比為1∶3∶4。下列判斷不正確的是
xC(g) ΔH<0,平衡時M中A、B、C的物質的量之比為1∶3∶4。下列判斷不正確的是

A. x=2
B. 若N中氣體的密度如圖Ⅲ所示,則A、B只有一種是氣態
C. A為氣體,B為非氣體,則平衡時M、N中C的物質的量相等
D. 若A、B均為氣體,平衡時M中A的轉化率小于N中A的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 反應A(g)+3B(g)![]() 2C(g)+2D(g),在四種不同情況下用不同物質表示的反應速率
2C(g)+2D(g),在四種不同情況下用不同物質表示的反應速率
分別如下,其中反應速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車的啟動電源常用鉛蓄電池,電池反應如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根據此反應判斷下列敘述中正確的是( )
2PbSO4+ 2H2O,根據此反應判斷下列敘述中正確的是( )
A. PbO2放電時是電池的負極,充電時是電池的陽極
B. 負極的電極反應式為:Pb + SO42—– 2e–=PbSO4
C. 放電時,PbO2得電子,被氧化
D. 電池放電時,溶液酸性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下,某反應達到平衡,平衡常數K=c(CO)c(H2O)/c(CO2)c(H2)。恒容時,溫度升高,H2濃度減小。下列說法正確的是
A. 該反應化學方程式為CO+H2O ![]() CO2+H2 B. 升高溫度,逆反應速率減小
CO2+H2 B. 升高溫度,逆反應速率減小
C. 恒溫恒容下,增大壓強,H2濃度一定減小 D. 該反應是焓變為正值
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一種或幾種組成,為了探究它的成份,進行了如下實驗:下列判斷正確的是( )

A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,CuSO4可能存在
D. C為單一溶質溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。現有1g液態H2O,蒸發時吸收的熱量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com