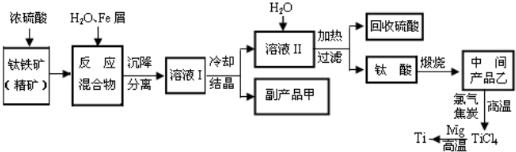
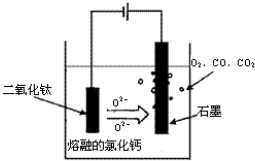
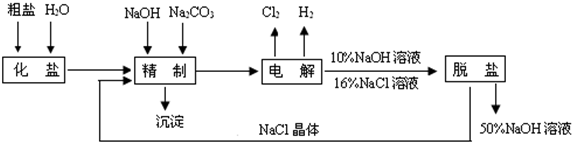
[化學--選修化學與技術]工業上以黃鐵礦為原料生產硫酸.
(1)寫出燃燒黃鐵礦的化學方程式
.
(2)接觸室中發生反應的化學方程式是
.
(3)判斷下列說法正確的是(選填序號字母)
abd
abd
.
a.為使黃鐵礦充分燃燒,需將其粉碎
b.過量空氣能提高SO
2的轉化率
c.使用催化劑能提高SO
2的反應速率和轉化率
d.沸騰爐排出的礦渣可供煉鐵
(4)吸收塔中用濃硫酸吸收三氧化硫而不用水的原因是
避免形成酸霧
避免形成酸霧
.
(5)吸收塔排出的尾氣可以用兩種方法處理:
方法①:先用氨水吸收,再用濃硫酸處理.用濃硫酸處理的主要目的是
獲得較高濃度的SO2
獲得較高濃度的SO2
;
方法②:先用含一定水的亞硫酸鈉吸收后再加熱處理,也可達到與方法①相同的目的.為了實現節能減排,其所需能量可以由
流程中三步驟產生的廢熱提供
流程中三步驟產生的廢熱提供
提供.與方法①相比,方法②的優點是
亞硫酸鈉可以循環利用
亞硫酸鈉可以循環利用
.
(6)SO
2既可作為生產硫酸的原料循環再利用,也可用于工業制溴過程中吸收潮濕空氣中的Br
2.SO
2吸收Br
2的離子方程式是
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
.



 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移動,導致Ca5(PO4)3OH溶解,造成齲齒
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移動,導致Ca5(PO4)3OH溶解,造成齲齒 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移動,導致Ca5(PO4)3OH溶解,造成齲齒
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移動,導致Ca5(PO4)3OH溶解,造成齲齒